

| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| 2 |
| 3 |


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省泰州市高三第一次模拟考试化学卷 题型:实验题
(12分)近年来高锰酸钾在饮用水和工业污水处理领域的消费增长较快。实验室可用软锰矿(主要成分MnO2)为原料制备高锰酸钾。其部分流程如下:
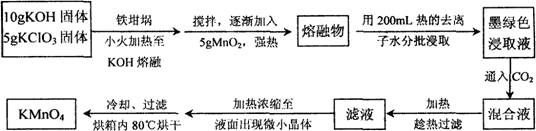
(1)实验中采用铁坩埚而不用瓷坩埚的原因是 ;
(2)KOH、KClO3、MnO2共熔制得绿色K2MnO4的化学方程式 ;
(3)通入CO2,可使MnO42-发生歧化反应,生成MnO4-及MnO2,则K2MnO4完成反应时,转化为KMnO4的百分率约 (精确至0.1%)
(4)若通入CO2太多,则在加热浓缩时,会有 晶体和KMnO4晶体一起析出。
(5)在加热、浓缩、烘干的过程中温度不宜过高,其原因是 ;加热时用玻璃棒不停搅拌溶液的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com