
【题目】质子膜N2H4燃料电池是一种高效无污染的新型电池(原理示意如图),其反应原理:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-544kJmol-1。下列说法正确的是

A.电极b上发生氧化反应
B.电极a为原电池正极
C.每32gO2参与反应,电池内部释放544kJ热能
D.电路中每通过1mol电子,有1molH+经质子膜进入正极区
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】![]()
![]() ,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高
,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高![]() 转化率的是( )
转化率的是( )
A.①②④B.①④⑥C.②③⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.lmol1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:CH3CH2CH=CH2(g)![]() CH2=CHCH=CH2(g)+H2(g)△H。
CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
(1)已知化学键键能数据如下,由此计算△H=____________kJmo1-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJmol-1 | 348 | 612 | 412 | 436 |
(2)如图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度600℃。
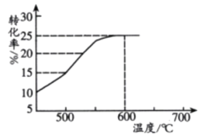
①请解释工业生产控制温度在600℃的原因___________。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=_________kPah-1;脱氢反应的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,p分=p总×物质的量分数)。
(3)在密闭容器中反应达到平衡后,再充入1.575mol1-丁烯和1.625mol1,3-丁二烯,化学反应向_________(填“正反应”、“逆反应或“不移动”)方向进行 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,X是周期表中非金属最强的元素,W与X同主族,Y、Z是同周期相邻的两种元素,Z元素原子最外层电子数等于周期序数。下列说法正确的是
A.原子半径的大小顺序;![]()
B.简单氢化物的热稳定性:![]()
C.最高价氧化物对应水化物的碱性:![]()
D.工业上,常用电解含Y或Z简单离子溶液的方法冶炼单质Y或Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末X中可能含有Na2O、CaO、CuO、Fe2O3和SiO2中的若干种,为确定其成分,现取X进行如下实验(所加试剂均过量),下列说法正确的是
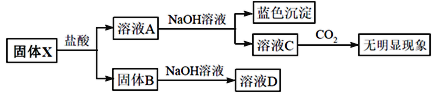
A.该混合物一定含有CuO、SiO2B.该混合物可能含有Na2O和Fe2O3
C.该混合物一定不含CaO和Na2OD.无法确定是否含有CaO和Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于同种物质中同一价态的同一元素部分被氧化,部分被还原的氧化还原反应的是( )
A.3Br2+6KOH![]() 5KBr+KBrO3+3H2O
5KBr+KBrO3+3H2O
B.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.2KNO3![]() 2KNO2+O2↑
2KNO2+O2↑
D.NH4NO3![]() N2O↑+2H2O
N2O↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,反应速率增大,平衡向逆反应方向移动
③压缩容器增大压强,平衡不移动,v正、v逆不变
④增大B的浓度,v正>v逆
⑤加入催化剂,B的转化率提高
A.①②B.②④C.①③D.②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。
(1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。
(2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。
(3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较金属性的强弱:Na_________K(填“>”、“<”或“=”);反应Na+KClNaCl+K↑能发生的原因是________________。
(2)COCl2是共价化合物,各原子均满足8电子稳定结构。写出COCl2的结构式__________。
(3)电解熔融氧化铝制备金属铝时,需要定期更换阳极石墨块,理由是_________________(用化学反应方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com