
F、Cl和Br都是VIIA族元素,关于这三种元素原子说法正确的是
A.原子半径:F>C1>Br B.最外层电子数都相同
C.核外电子层数都相同 D.最外层电子数都不相同
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:阅读理解
 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.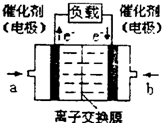
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
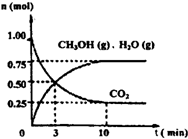
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1mol CO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________
②下列措施中一定不能使CO2的转化率增大的是______________。
A.在原容器中再充入lmolCO2
B.在原容器中再充入1molH2
C.在原容器中充入lmol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3 +H+的电离平衡常数 K=____________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将4.48LCO2通入200mLl.5mol/L的NaOH溶液,所得溶液中离子浓度由大到小的顺序为_______________。
(4)如图是甲醇燃料电池(电解质溶液为H2SO4溶液)的
结构示意图,则a处通入的是___________(填“甲醇”
或“氧气”),其电极上发生的电极反应式为____________。
(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13.向BaBr2溶液中加入AgNO3和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为____________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省信阳市毕业班第二次调研考试化学试卷 题型:填空题
(13分)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1moleO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________

②下列措施中一定不能使CO2的转化率增大的是______________。
A.在原容器中再充入lmolCO2
B.在原容器中再充入1molH2
C.在原容器中充入lmol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3 
 +H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将4.48LCO2通入200mLl.5mol/L
的NaOH溶液,所得溶液中离子浓度由大到小的顺序为
_______________。
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是___________(填“甲醇”或“氧气”),其电极上发生的电极反应式为____________。

(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13.向BaBr2溶液中加入AgNO3和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为____________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省高三下学期第一次月考理科综合试卷(化学部分) 题型:填空题
(14分)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1mol CO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
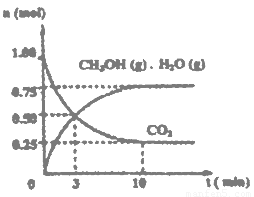
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________
②下列措施中一定不能使CO2的转化率增大的是______________。
A.在原容器中再充入lmolCO2
B.在原容器中再充入1molH2
C.在原容器中充入lmol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3 
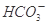 +H+的电离平衡常数 K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数 K=____________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将4.48LCO2通入200mLl.5mol/L的NaOH溶液,所得溶液中离子浓度由大到小的顺序为_______________。
(4)如图是甲醇燃料电池(电解质溶液为H2SO4溶液)的
结构示意图,则a处通入的是___________(填“甲醇”
或“氧气”),其电极上发生的电极反应式为____________。
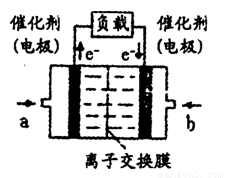
(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13.向BaBr2溶液中加入AgNO3和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为____________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省商丘市高三第二次模拟考试(理综)化学部分 题型:填空题
如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。

(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=__________________________.
②下列措施中一定不能使CO2的转化率增大的是________________。
A.在原容器中再充入1molCO2 B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气 D.使用更有效的催化剂
E.缩小容器的容积 F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3
 +H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将4.48LCO2通入200mL1.5mol/L的NaOH溶液,所得溶液中离子浓度由大到小的顺序为_____________。
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的
结构示意图,则a处通入的是_________(填“甲醇”或
“氧气”),其电极上发生的电极反应式为_____________。

(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13. 向BaCl2溶液中加入AgNO3和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com