
| A、④ | B、② | C、③ | D、① |
| m |
| M |
| N |
| NA |
| m |
| ρ |
| 14g |
| 18g/mol |
| 3.612×1023 |
| 6.02×1023mol-1 |
| 10.8g |
| 1g/mL |


科目:高中化学 来源: 题型:
| A、溶液呈碱性 |
| B、c(NH3?H2O)+c(NH4+)=0.1mol/L |
| C、c(NH4+)+c(H+)=c(OH-)+c(Cl-) |
| D、氯化铵的加入可促进水的电离,使Kw>1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| A、X、Y、Z中最简单氢化物稳定性最弱的是Z |
| B、Z和Y元素的氧化物对应水化物的酸性Z一定强于Y |
| C、简单阴离子的还原性:X<Y |
| D、最简单氢化物的沸点:X<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C3H4和C2H6 |
| B、C3H6和C3H8O |
| C、C3H6O2和C3H8O |
| D、C3H8O和C4H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、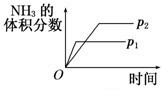 压强对反应的影响(p2>p1) |
B、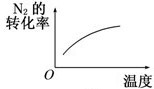 温度对反应的影响 |
C、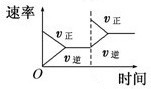 平衡体系增加N2对反应的影响 |
D、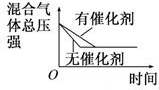 催化剂对反应的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )| A、原子半径的大小顺序为:rZ>rW>rX>rY |
| B、元素W的含氧酸的酸性一定比Z的含氧酸的酸性强 |
| C、工业上是通过电解法获得元素W的单质 |
| D、XZ2和XW4中化学键的类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g金属镁变为镁离子时失去的电子数为0.2NA |
| B、2.7g金属铝所含电子数目为0.3NA |
| C、0.5 mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA |
| D、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向溴水中通入SO2气体 | 溶液褪色 | SO2具有漂白性 |
| B | 向淀粉水解液中加入NaOH溶液至碱性,再加入新制Cu(OH)2,煮沸 | 有砖红色沉淀生成 | 淀粉已水解 |
| C | 向某钠盐X的溶液中先滴加稀盐酸,无现象,再滴加BaCl2溶液 | 出现白色沉淀 | X一定是Na2SO4 |
| D | BaSO4固体加入饱和Na2CO3溶液中,过滤,向滤渣中加入盐酸 | 有气体生成 | Ksp(BaSO4)>Ksp(BaCO3) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g铁片投入到冷的浓硫酸中,铁片失去电子数为0.3NA |
| B、16g CH4中含有4NA个C-H键 |
| C、标准状况下,3g NO与1.6g O2混合气体所含有的分子数为0.1NA |
| D、标准状况下,5.6L四氯化碳含有的分子数为0.25NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com