
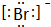 .
. .
. 分析 第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数按A、B、C、D顺序增大,A与B的次外层电子数位8,则A为K、B为Ca,而C与D的次外层电子数为18,则C为Zn、D为Br,据此解答.
解答 解:第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数按A、B、C、D顺序增大,A与B的次外层电子数位8,则A为K、B为Ca,而C与D的次外层电子数为18,则C为Zn、D为Br,
(1)由上述分析可知,A为钾、B为钙、C为锌、D为溴,故答案为:钾;钙;锌;溴;
(2)Br-离子的电子式是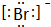 ,故答案为:
,故答案为: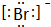 ;
;
(3)B与D形成的化合物为CaBr2,故答案为:CaBr2;
(4)Ca元素原子4s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能K<Ca,故答案为:K<Ca;
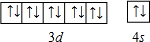
(5)用电子排布图表示Zn基态原子的外围电子排布为 ,故答案为:
,故答案为: .
.
点评 本题考查结构与位置关系应用,涉及核外电子排布、电子式等,推断元素是解题关键,难度不大,注意理解掌握同周期主族元素第一电离能异常情况.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯、苯酚、酒精灯 | B. | 乙烷、乙烯、溴水 | ||
| C. | 乙醇、水、金属钠 | D. | 苯、环己烷、高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | B. | 空气:C2H2、CO2、SO2、苯酚 | ||
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | D. | 高锰酸钾溶液:H+、Na+、SO42-、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,乙炔的电子式为
,乙炔的电子式为
 的名称是3,3,4-三甲基己烷;
的名称是3,3,4-三甲基己烷; CH2=CH-CO18OCH2CH3+H2O.
CH2=CH-CO18OCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com