
2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为: 。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。 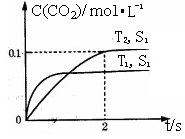
据此判断:
①该反应的△H 0(填“>”、“<”)。
②在T2温度下,0~2s内的平均反应速率v(N2)= 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是 (填代号) 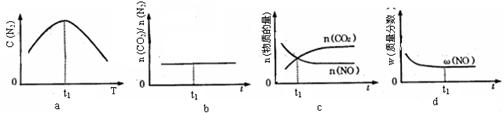
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
例如: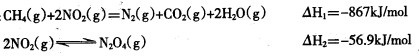
写出CH4 (g)催化还原N2O4(g)生成N2 (g)和H2O (g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为 。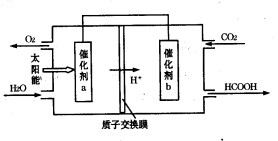
(14分)(1) ①<.(2分) ② 0.025mol/(L·s)(3分).
③ 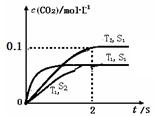 (2分) ④ a d(2分)
(2分) ④ a d(2分)
(2) ① CH4(g)+N2O4(g) = N2(g)+CO2(g)+2H2O(g)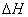 = -810.1KJ/mol。(3分)
= -810.1KJ/mol。(3分)
② CO2+2H++2e-=HCOOH.(2分)
解析试题分析:(1)①根据图像可知在催化剂表面积相同的条件下,T1首先达到平衡状态,这说明温度是T1大于T2。但温度高CO2的浓度低,这说明升高温度平衡向逆反应方向移动,所以正方应是放热反应,即△H小于0。
②在T2温度下,0~2s内CO2的浓度增加了0.1mol/L,则氮气的浓度增加了0.05molk/L,所以氮气的平均反应速率v(N2)=0.05mol/L÷2s=0.025mol/(L·s)。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,则反应达到平衡的时间减少,但平衡状态是不变的,所以曲线是(见答案)。
④在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以d可以说明。由于该反应是放热反应,所以升高温度平衡向逆反应方向移动,则氮气的浓度是降低的,所以a图像可以说明,正确;根据方程式可知CO2和氮气的物质的量总是满足2:1的,所以b图像不能说明,b不正确;平衡时浓度不再生变化,但物质之间的浓度不一定相等或满足某种关系,所以选项c中不能说明,且二者的浓度是变化的,没有达到平衡状态,答案选ad。
(2)①根据盖斯定律可知,前者减去后者,即得到反应CH4(g)+N2O4(g)= N2(g)+CO2(g)+2H2O(g),所以该反应的反应热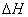 =-867kJ/mol+56.9kJ/mol=-810.1kJ/mol。
=-867kJ/mol+56.9kJ/mol=-810.1kJ/mol。
②根据装置图可知,氢离子向b电极移动,这说明b电极是正极,得到电子,发生还原反应,所以电极反应式是CO2+2H++2e-=HCOOH。
考点:考查反应热的判断、外界条件对平衡状态的影响、平衡状态的判断、反应速率和反应热的计算以及电极反应式的书写
点评:该题是高考中的常见题型,难度大,综合性强,对学生的要求高。试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力,提升学生的学科素养。


科目:高中化学 来源: 题型:阅读理解

| 催化剂 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第6讲 化学反应速率和化学平衡练习卷(解析版) 题型:填空题
2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。

据此判断:
①该反应的ΔH________0(填“>”或“<”)
②在T2温度下,0~2 s内的平均反应速率v(N2)=______________________。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填代号)。


(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ/mol
2NO2(g)??N2O4(g) ΔH2=-56.9 kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:________________________________________________________________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的
目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为__________________________。

③常温下,0.1 mol·L-1的HCOONa溶液pH为10,则HCOOH的电离常数Ka=________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省高三上学期12月月考化学试卷(解析版) 题型:填空题
Ⅰ、下列实验操作或对实验事实的描述正确的是____________________
① 用量筒量取稀硫酸溶液8.0mL;
②中和热的测定实验中,可用金属丝(棒)代替环形搅拌玻璃棒;
③用热的浓盐酸洗涤附着有MnO2的试管;
④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;
⑤Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;
⑥用碱式滴定管量取KMnO4溶液20.50mL ;
⑦将水沿烧杯内壁缓缓注入浓硫酸中,不断用玻璃棒搅拌以稀释浓硫酸;
⑧用湿润的pH试纸测量某溶液pH时,测量值一定比真实值小;
⑨锌和一定量稀硫酸反应,为加快速率而不影响H2的量可向溶液中加适量Cu(NO3)2晶体。
Ⅱ、2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+
N2(g)。△H<0
2CO2(g)+
N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。


(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
②2NO2(g)
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市高三第四次月考化学试卷(解析版) 题型:填空题
2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为: 。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。

据此判断:
①该反应的△H 0(填“>”、“<”)。
②在T2温度下,0~2s内的平均反应速率v(N2)= 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是 (填代号)

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
例如:

写出CH4 (g)催化还原N2O4(g)生成N2 (g)和H2O (g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com