
氧化铁在工业上具有广泛的应用。
I.据报道,一定条件下利用FeO2与甲烷反应可制取“纳米级”的金属铁。其反应如下:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g)? △H>0
(1)若反应在2L的密闭容器中进行,5min后达到平衡,测得反应生成Fe的质量为l.12g。则该段时间内CH4的平均反应速率为 ________________。
(2)反应达到平衡后,保持其他条件不变,仅改变某一相关元素,下列说法正确的是___(选填序号)。
a.若加入催化剂,v正增大,平衡向右移动
b.若温度升高,平衡常数K减小
c.若增大Fe2O3的量,平衡向右移动
d.若从反应体系中移走部分CO,可提高CH4的转化率
Ⅱ.工业上利用硫铁矿烧渣(主要成分为Fe2O3、A12O3、SiO2等)为原料提取Fe2O3,工艺
流程如下:试回答下列问题:

(3)步骤i烧渣中A12O3溶解的离子方程式为________________。
(4)步骤i、ⅱ、ⅲ都要进行的操作名称是__________________。
(5)结合下图,判断步骤ⅱ中调节溶液的pH不高于_________________。

(6)已知

计算反应Fe2+(aq)+2HCO3-(aq) FeCO3(s)+H2CO3(aq)的平衡常数为_______。
FeCO3(s)+H2CO3(aq)的平衡常数为_______。
(7)在空气中煅烧FeCO3生成氧化铁的化学方程式为____________。
(8)结合所学化学知识,请你设计在实验室里从上述的硫铁矿烧渣中提取氧化铁的另一种简单方案。
(1)0.003mol/(L·min)没有单位扣1分)
(2)d
(3)Al2O3+6H+=2Al3++3H2O
(4)过滤
(5)7
(6)4.06×106或4.1×106
(7)4FeCO3+O2 2Fe2O3+4CO2
2Fe2O3+4CO2
(8)取少量硫铁矿烧渣,加入足量热的浓氢氧化钠溶液,搅拌、过滤、洗涤、烘干(答案合理即可得分)
【解析】
试题分析:I.(1)5min后达到平衡,测得反应生成Fe的质量为l.12g,物质的量是1.12g÷56g/mol=0.02mol。因此根据方程式可知消耗甲烷的物质的量是0.03mol,其浓度是0.015mol/L,所以用甲烷表示的反应速率是0.015mol/L÷5min=0.003mol/(L·min)。
(2)a.加入催化剂,正逆反应速率均增大,平衡不移动,a不正确;b.正方应是吸热反应,因此若温度升高,平衡向正反应方向移动,所以平衡常数K增大,b不正确;c.氧化铁是固体,因此若增大Fe2O3的量,平衡不移动,c不正确;d.若从反应体系中移走部分CO,降低生成物浓度,平衡向正反应方向移动,因此可提高CH4的转化率,d正确,答案选d。
Ⅱ.(3)A12O3溶解在稀硫酸中反应的离子方程式为Al2O3+6H+=2Al3++3H2O。
(4)步骤i、ⅱ、ⅲ中都产生不溶性固体,因此都要进行的操作名称是过滤。
(5)根据图像可知,亚铁离子开始沉淀时的pH值是7,所以要得到碳酸亚铁,则溶液的pH不能高于7,因此步骤ⅱ中调节溶液的pH不高于7。
(6)反应Fe2+(aq)+2HCO3-(aq) FeCO3(s)+H2CO3(aq)的平衡常数K=
FeCO3(s)+H2CO3(aq)的平衡常数K=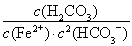 =
=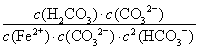 =
=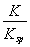 =
= =4.06×106。
=4.06×106。
(7)根据原子守恒可知,在空气中煅烧FeCO3生成氧化铁的同时还有CO2生成,因此反应的化学方程式为4FeCO3+O2 2Fe2O3+4CO2。
2Fe2O3+4CO2。
(8)由于氧化铝与二氧化硅均能和氢氧化钠溶液反应,而氧化铁与氢氧化钠溶液不反应,因此要提取氧化铁的实验方案可设计为取少量硫铁矿烧渣,加入足量热的浓氢氧化钠溶液,搅拌、过滤、洗涤、烘干。
考点:考查反应速率计算、外界条件对平衡状态和反应速率的影响;方程式书写、物质的分离与提纯、实验方案设计、平衡常数的有关计算


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

| △ |
| △ |
| 催化剂 |

| 催化剂 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 水 | |
| CS2 | -110.8 | 46.5 | 1.26 | 难溶 |
| S2Cl2 | -76 | 138 | 1.75 | 水解 |

查看答案和解析>>
科目:高中化学 来源:2014届山东省文登市高三上学期期中统考理综化学试卷(B)(解析版) 题型:填空题
(15分)烧碱(NaOH)和纯碱(Na2CO3)与硫酸、盐酸和硝酸并称为工业上的“三酸两碱”。按要求回答下列问题:
(1)完成下列有关NaOH溶液参加反应的离子方程式
①向NaOH溶液中加入铝片:_______________________;
②向NaOH溶液中滴加少量氯化铝溶液___________________;
③二氧化氮与NaOH溶液发生氧化还原反应:___________________;
④用热的NaOH溶液洗涤沾有硫单质的试管:___________________;
(2)下列是碳酸钠和碳酸氢钠的性质比较,用“>”“<”“=”填空:
①热稳定性:Na2CO3_______NaHCO3;
②与稀盐酸反应快慢:Na2CO3_______NaHCO3;
③物质的量相同时,消耗盐酸的物质的量:Na2CO3_______NaHCO3。
(3)在10 mL 1 mol/L的纯碱溶液中,不断搅拌并逐滴加入10 mL 1.5 mol/L盐酸,完全反应后,在标准状况下生成二氧化碳的体积为____________L。
(4)碳酸钠在工业上具有广泛的作用,碳酸钠可以用作下列工业生产主要原料的是_____(填编号)
a.玻璃 b.水泥 c.造纸 d.海水提取镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com