
����Ŀ����ҵ�ϳ��������ջ��������Ʊ�SO2 �� ͬʱ������������������Ҫ�ɷ��Ǻ�����������Ͷ�������ȣ����������Ʊ���Ч��ˮ���ۺ����������Դﵽ��Դ�ۺ����õ�Ŀ�ģ��乤��������ͼ�� 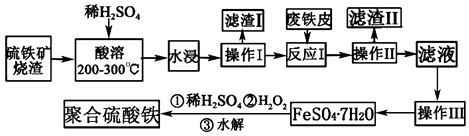
��1�����顰��ӦI�������Һ���Ƿ���Fe3+���Լ��� ��
��2������I����Ҫ�ɷ��� ��
��3��������III���о���ķ�������Ϊ�������˺�ϴ�ӣ�
��4����������H2O2��Ŀ���ǽ�Fe2+����ΪFe3+ �� ����ʱ����Ʒ�Ӧ�¶�Ϊ50��60���ԭ���� ��
��5�����ɾۺ��������Ĺ�������ˮ���پۺϣ��ۺϵĻ�ѧ����ʽΪmFe2��OH��n��SO4�� ![]() [Fe2��OH��n��SO4��
[Fe2��OH��n��SO4�� ![]() ]m��д��ˮ��Ļ�ѧ����ʽ
]m��д��ˮ��Ļ�ѧ����ʽ
���𰸡�
��1��KSCN��Һ
��2��SiO2
��3������Ũ������ȴ�ᾧ
��4���¶ȵͣ���Ӧ���������¶ȸߣ�H2O2�ֽ�ӿ죬������������������
��5��Fe2��SO4��3+nH2O?Fe2��OH��n��SO4Fe2��SO4��3+nH2O?Fe2��OH��n��SO4����3�� ![]() ��+
��+ ![]() H2SO4����3��
H2SO4����3�� ![]() ��+
��+ ![]() H2SO4
H2SO4
���������⣺��������������Ҫ�ɷ���Fe3O4��Fe2O3��FeO�Ͷ������裩��������������ܣ�ˮ�������˳���������Ķ������裬��Һ�к����������������������ӷ���Ƥ��Fe�����������ӷ�Ӧ�����������ӣ�����ȥ�������������ҺΪ����������Һ��Ȼ������Ũ������ȴ�ᾧ���õ������������壬�����м�ϡ���ᡢ˫��ˮ�õ��ۺ�����������1�����顰��ӦI�������Һ���Ƿ���Fe3+���Լ���KSCN��Һ������������KSCN��Һ��Ѫ��ɫ����ô�����ӵĴ��ڣ����Դ��ǣ�KSCN��Һ����2����������������Ҫ�ɷ���Fe3O4��Fe2O3��FeO�Ͷ������裩��������������ܣ�ˮ�������˳���������Ķ������裬����I����Ҫ�ɷ���SiO2 �� ���Դ��ǣ�SiO2����3������III��������Һ�õ�����FeSO47H2O������ķ�������Ϊ������Ũ������ȴ�ᾧ�����˺�ϴ�ӣ����Դ��ǣ�����Ũ���������Ũ������ ��ȴ�ᾧ����4����������H2O2��Ŀ���ǽ�Fe2+����ΪFe3+ �� ����ʱ����Ʒ�Ӧ�¶�Ϊ50��60���ԭ����Ϊ�˼ӿ췴Ӧ���ʣ���ֹ��������ֽ⣬��Ϊ�¶ȵͣ���Ӧ���������¶ȸߣ�H2O2�ֽ�ӿ죬�����������������ӣ����Դ��ǣ��¶ȵͣ���Ӧ���������¶ȸߣ�H2O2�ֽ�ӿ죬�����������������ӣ���5�����ɾۺ��������Ĺ�������ˮ���پۺϣ��ۺϵĻ�ѧ����ʽΪmFe2��OH��n��SO4�� ![]() [Fe2��OH��n��SO4��
[Fe2��OH��n��SO4�� ![]() ]m �� ˮ��Ļ�ѧ����ʽΪ��Fe2��SO4��3+nH2OFe2��OH��n��SO4����3��
]m �� ˮ��Ļ�ѧ����ʽΪ��Fe2��SO4��3+nH2OFe2��OH��n��SO4����3�� ![]() ��+
��+ ![]() H2SO4 ��
H2SO4 ��
���Դ��ǣ�Fe2��SO4��3+nH2OFe2��OH��n��SO4����3�� ![]() ��+
��+ ![]() H2SO4 ��
H2SO4 ��


 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ��ͨ��CO2���壬�����ܲ����������ǣ� ��
A. �Ȼ��ƺ����ᱵ�Ļ��Һ B. ϡ��ˮ����
C. ƫ��������Һ D. ̼���Ʊ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1������VSEPRģ���жϣ�������������ԭ�Ӷ���ͬһƽ���ϵ�һ���� ��
A.SO32����NO2��
B.NO3����SO3
C.H3O+��ClO3��
D.PO43����SO32��
��2��CaF2�ľ�����ͼ��ʾ�� 
�������й�CaF2�ı�����ȷ����
a��Ca2+��F��������ھ�����������
b��F�������Ӱ뾶С��Cl�� �� ��CaF2���۵����CaCl2
c�����������ӱ�Ϊ2��1�����ӻ��������CaF2���幹����ͬ
d��CaF2�еĻ�ѧ��Ϊ���Ӽ������CaF2������״̬���ܵ���
��CaF2������ˮ���������ں�Al3+����Һ�У�ԭ�����������ӷ���ʽ��ʾ����֪[AlF6]3������Һ�п��ȶ����ڣ���
�۾�����F������λ���� �� ��һ��Ca2+�Ⱦ����������Ca2+������
��3��ͭ��п����Ԫ�صĵ�һ�����ܡ��ڶ������������ʾ
������/kJmol��1 | I1 | I2 |
ͭ | 746 | 1958 |
п | 906 | 1733 |
��д��Cuԭ�Ӻ�������Ų�ʽ��
��ͭ�ĵ�һ�����ܣ�I1��С��п�ĵ�һ�����ܣ���ͭ�ĵڶ������ܣ�I2��ȴ����п�ĵڶ������ܣ�����Ҫԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ǧ�ʵIJ�������Ӧ��ҵ����Ӧ����
A����Ƥ����������ҵ B�����Ͻ�Ƭ����ұ����ҵ
C������о���������ҵ D��Ǧ��������Ϳ����ҵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϸ��ڵ�������Ҫ�ɷ��Ǽ��ᣨ�ṹʽΪ ![]() ��Ka=1.8��10��4����ͨ���������һ����ɫ�ӷ���Һ�壮������Ũ�������������ֽ����CO��ij��ѧ��ȤС���ͬѧ��HCOOH�����ʽ���������̽����
��Ka=1.8��10��4����ͨ���������һ����ɫ�ӷ���Һ�壮������Ũ�������������ֽ����CO��ij��ѧ��ȤС���ͬѧ��HCOOH�����ʽ���������̽����
��1������ͬѧѡ����ͼ1��ʾ��װ��̽��HCOOH��Ũ���������·ֽ������CO����������и�С�⣮ 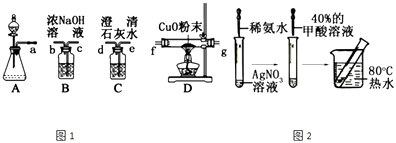
��i��д������ֽ�Ļ�ѧ����ʽ��
��ii��װ�õ�����˳��a��
��iii��HCOOH�ķֽ��������CO��������
��iv����ʵ�������һ�����Ե�ȱ������
��2������ͬѧ�����˼�����ӽṹ����Ϊ�����ܷ���������Ӧ�����������ͼ2��ʾ��ʵ�飮
��i����ͼ��ʾ��ʵ�飬����20���Ӻ�û�г��ֹ����������������ʵ����û�в���������ԭ����
��ii�������ʵ������֤��Ľ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1������VSEPRģ���жϣ�������������ԭ�Ӷ���ͬһƽ���ϵ�һ���� ��
A.SO32����NO2��
B.NO3����SO3
C.H3O+��ClO3��
D.PO43����SO32��
��2��CaF2�ľ�����ͼ��ʾ�� 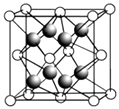
�������й�CaF2�ı�����ȷ����
a��Ca2+��F��������ھ�����������
b��F�������Ӱ뾶С��Cl�� �� ��CaF2���۵����CaCl2
c�����������ӱ�Ϊ2��1�����ӻ��������CaF2���幹����ͬ
d��CaF2�еĻ�ѧ��Ϊ���Ӽ������CaF2������״̬���ܵ���
��CaF2������ˮ���������ں�Al3+����Һ�У�ԭ�����������ӷ���ʽ��ʾ����֪[AlF6]3������Һ�п��ȶ����ڣ���
�۾�����F������λ���� �� ��һ��Ca2+�Ⱦ����������Ca2+������
��3��ͭ��п����Ԫ�صĵ�һ�����ܡ��ڶ������������ʾ
������/kJmol��1 | I1 | I2 |
ͭ | 746 | 1958 |
п | 906 | 1733 |
��д��Cuԭ�Ӻ�������Ų�ʽ��
��ͭ�ĵ�һ�����ܣ�I1��С��п�ĵ�һ�����ܣ���ͭ�ĵڶ������ܣ�I2��ȴ����п�ĵڶ������ܣ�����Ҫԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������14C������˵���в���ȷ���ǣ� ��
A. 14Cԭ����C60����̼ͨԭ�ӵĻ�ѧ������ͬ
B. 14Cԭ����14Nԭ��������������ͬ
C. ��C60��ͬ��������
D. ��12C��13C��̼Ԫ�ص�����ͬλ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����1��Zn��s��+ ![]() O2��g���TZnO��s����H=��348.3kJmol��1 �� ��2��2Ag��s��+
O2��g���TZnO��s����H=��348.3kJmol��1 �� ��2��2Ag��s��+ ![]() O2��g���TAg2O��s����H=��31.0kJmol��1 �� ��Zn��s��+Ag2O��s���TZnO��s��+2Ag��s���ġ�H���ڣ� ��
O2��g���TAg2O��s����H=��31.0kJmol��1 �� ��Zn��s��+Ag2O��s���TZnO��s��+2Ag��s���ġ�H���ڣ� ��
A.��379.3kJmol��1
B.��317.3kJmol��1
C.��332.8kJmol��1
D.317.3kJmol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com