
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。请回答下列问题:
(1)目前,以下“技术”中,可用于“海水淡化”的是___________________________
(填序号)。
①蒸馏法 ②膜分离法(电渗析、反渗透) ③冷冻法 ④离子交换法
(2)海 水晒盐利用的化学原理是____________________________________________;
水晒盐利用的化学原理是____________________________________________;
分离食盐晶体后的母液中含有____________,经过分离、提纯后,可用于_________。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应的 离子方程式为________________________________________________________________________;
离子方程式为________________________________________________________________________;
电解所用的食盐水需要精制,其原因是_____________________________________
________________________________________________________________________;
精制时所用试剂:盐酸、BaCl2溶液、NaOH溶液、Na2CO3溶液,加入试剂时,Na2CO3溶液必须在加入__________________________________________________________之后加入。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫的废气同时回收二氧化硫的方法,该方法的流程如下:
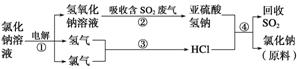
写出反应②、④的化学方程式:_____________________________________________、
________________________________________________________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列有关化学用语使用正确的是
A.NH4Br的电子式: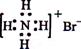 B.S2-的结构示意图:
B.S2-的结构示意图:
C.乙酸的分子式: CH3COOH D.原子核内有l8个中子的氯原子: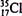
查看答案和解析>>
科目:高中化学 来源: 题型:
美国科学家理查德·海克和日本科学家根岸英一、铃木彰因在研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂,长期使用催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收。一种由废催化剂制取氯化钯的工艺流程如下:
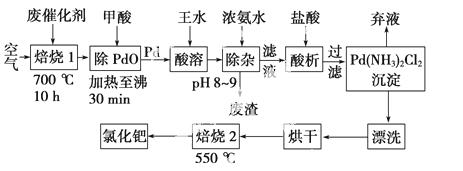
(1)废钯催化剂经烘干后,再在700 ℃的高温下焙烧,焙烧过程中需通入足量空气的原因是________________________________________________________________________;
甲酸还原氧化钯的化学方程式为____________________ ______________________。
______________________。
(2)钯在王水(浓硝酸与浓盐酸按体积比1∶3)中转化为H2PdCl4,硝酸还原为NO,该反应的化学方程式为______________________。
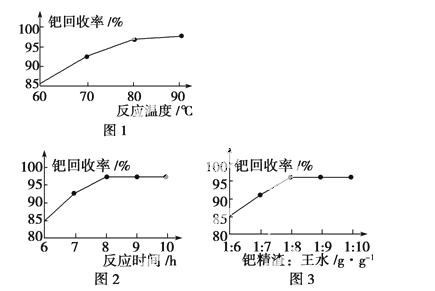
(3)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如下图1~图3所示,则王水溶解钯精渣的适宜条件(温度、时间和王水用量)为__________、__________、__________。
(4)加浓氨水时,钯转变为可溶性[Pd(NH3)2]2+,此时铁的存在形式是________________________________________________________________________(写化学式)。
(5)700 ℃焙烧1的目的是________________;550 ℃焙烧2的目的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图模 拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
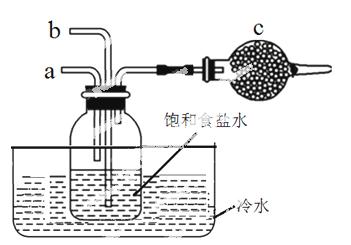
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是 。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有 。
(3)高纯硅是现代信息、半 导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
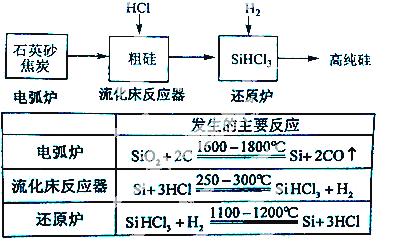
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为 ;碳化硅又称 ,其晶体结构与 相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、 SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 。
SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 。
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | Si |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的产物为 。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)①BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
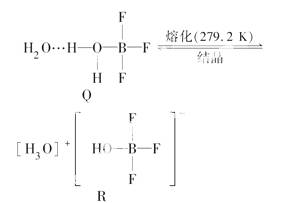
晶体Q中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②已知苯酚具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子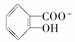 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是__________________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是__________________。
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/ (kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
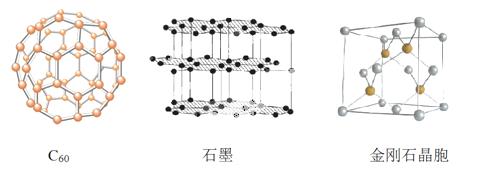
回答下列问题:
(1)金刚石、石墨、C60 .碳纳米管等都是碳元素的单质形式,它们互为_____________。
.碳纳米管等都是碳元素的单质形式,它们互为_____________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为____、____。
(3)C60属于____晶体,石墨属于____晶体。
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的____共价键,而石墨层内的C-C间不仅存在____共价键,还有____键。
(5)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬 球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(不要求计算结果)。
球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是常见的不同主族的短周期元素,它们的原子序数逐渐增大。已知其中只有一种是金属元素,C元素原子最外层电子数是D元素原子的最外层电子数的一半,B元素原子的最外层电子数比D元素原子的最外层电子数少2个。E、F也是短周期元素,E与D同主族,F与A同主族。
(1)写出F2E2的电子式:_____________________,
其晶体类型为________,其化学键类型为____________________。
(2)E与D各自形成的氢化物中沸点较高的是____ ____(填化学式),其原因是___________________________,
____(填化学式),其原因是___________________________,
A与B所形成最简单化合物的结构式为________,空间构型为________。
(3)六种元素中的三种组成的易溶于水的酸性物质中,能促进水电离的物质M是___________________
(写化学式,写一个 即可,下同),能抑制水电离的物质N是________。
即可,下同),能抑制水电离的物质N是________。
25 ℃时,pH=a的M溶液中由水电离出的H+浓度与pH=a的N溶液中由水电离出的H+浓度之比为________。
(4)甲、乙、丙分别是B、C、D三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙的用量不同,反应的产物不同。回答下列问题:
①向乙溶液中缓慢滴加过量的丙溶液,过程中发生反应的离子方程式为___________________。
②向甲溶液中缓慢滴加过量的丙溶液,所观察到的实验现象为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.1 mol氢约含有6.02×1023个微粒
B.1 mol H2O中含有的氢原子数为2NA
C.钠的摩尔质量等于它的相对原子质量
D.1 mol硫酸的质量等于98 g/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com