
科目:高中化学 来源: 题型:
| A | |||||||||||||||||
| B | C | D | E | ||||||||||||||
| F | G | H | I | ||||||||||||||
| J | K | L | M | ||||||||||||||


查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纵行 横行 |
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I |
查看答案和解析>>
科目:高中化学 来源:北京期中题 题型:填空题
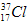 的中子数为______,该氯原子与
的中子数为______,该氯原子与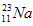 原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。
原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。
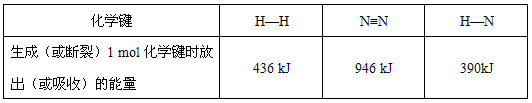
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com