
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s)
Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-![]() Mn2O3(s)+2OH-(aq)
Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小
查看答案和解析>>
科目:高中化学 来源: 题型:
A.电池负极(锌筒)的电极反应式为:Zn-2e-====Zn2+
B.电池正极(石墨)的电极反应式为:2MnO2+2![]() +2e-====Mn2O3+2NH3+H2O
+2e-====Mn2O3+2NH3+H2O
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小
查看答案和解析>>
科目:高中化学 来源:2013届浙江省绍兴市高二下学期期末考试化学试卷(解析版) 题型:选择题
锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
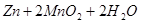 =
=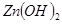
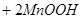 ,下列说法错误的是
,下列说法错误的是
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为: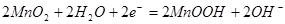
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过 电子,锌的质量理论上减少
电子,锌的质量理论上减少
查看答案和解析>>
科目:高中化学 来源:2013届山东省高一下学期期末考试化学试卷 题型:选择题
燃料电池是燃料(例如CO、H2、CH4等)跟氧气或空气起反应,将此反应的化学能转变为电能的装置,电解质溶液通常是KOH溶液。下列关于甲烷燃料电池的说法错误的是
A.负极反应式为CH4 + 10OH--8e-=== CO32-+ 7H2O
B.正极反应式为O2 + 2H2O + 4e-=== 4OH-
C.随着不断放电,电解质溶液碱性不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com