
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.氯化铝 | B.硫酸铜 | C.硝酸钠 | D.稀硫酸 |
查看答案和解析>>
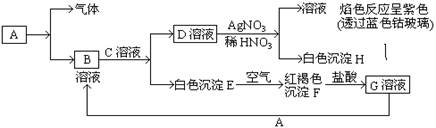
科目:高中化学 来源:不详 题型:实验题
| A.胶体粒子能透过滤纸,但不能透过半透膜 |
| B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
| C.只有胶体粒子能做布朗运动 |
| D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失 |
查看答案和解析>>
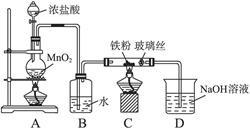
科目:高中化学 来源:不详 题型:填空题

 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________; (2)实验中观察到的主要现象是:
(2)实验中观察到的主要现象是: ①_______________________________ ;
①_______________________________ ; ②_______________________________ ;
②_______________________________ ; ③_______________________________ ;
③_______________________________ ; ④_______________________________ 。
④_______________________________ 。 (3)用该装置做铜与浓硝酸反应实验的优点:______________ ;
(3)用该装置做铜与浓硝酸反应实验的优点:______________ ; (4)大烧杯内最终所得气体产物的化学式: ;若要验证此气体产物,最简便的方法:_________________________________________ 。
(4)大烧杯内最终所得气体产物的化学式: ;若要验证此气体产物,最简便的方法:_________________________________________ 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com