
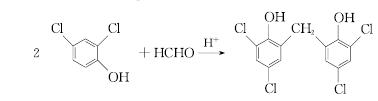
顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下:


(1)CH2=CH-CH=CH2的名称是_______;
(2)反应I的反应类型是_______;
a.加聚反应 b.缩聚反应
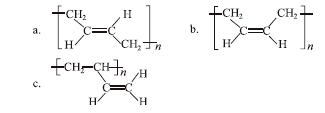
(3)顺式聚合物P的结构式是(选填字母)_______;
(4)A的相对分子质量为108.
①反应II的化学方程式是_____________________
②1molB完全转化为M所消耗的H2的质量是______g。
(5)反应III的化学方程式是______________________________。
(6)A的某些同分异构体在相同反应条件下也能生成B和C,写出其中一种同分异构体的结构简式__________。
(1)1,3-丁二烯
 (2)a (3)b
(2)a (3)b
 (4)①2CH2===CH——CH=== CH2
(4)①2CH2===CH——CH=== CH2
②6
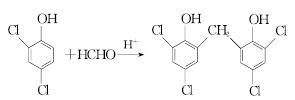 (5)2 +H2O
(5)2 +H2O
 |
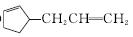 (6)或
(6)或
[解析] (1) CH2===CH——CH=== CH2为二烯烃,需要注明双键的位置,故命名为1,3丁二烯。(2)根据流程反应Ⅰ得到顺式聚合物,则反应Ⅰ发生加聚反应,生成顺式聚1,3丁二烯,故反应类型为加聚反应。(3)顺式聚合物P为顺式聚1,3丁二烯,结构简式为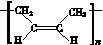 ,选b。
,选b。
(4)①CH2===CH——CH=== CH2的相对分子质量为54,A的相对分子质量为108,根据信息ⅰ、ⅱ确定为两分子1,3丁二烯发生成环反应,故化学方程式为
 | |||
 | |||
2CH2===CH——CH=== CH2
 ②根据信息ii和B到M的转化,确定醛基为3个,需要消耗氢气3分子,故1 mol B转化为M消耗氢气3 mol,质量为6 g。
②根据信息ii和B到M的转化,确定醛基为3个,需要消耗氢气3分子,故1 mol B转化为M消耗氢气3 mol,质量为6 g。
(5)根据A的结构简式和信息ⅱ确定C为甲醛,1 mol甲醛消耗2 mol 得到N,此反应的化学方程式为
 |
+H2O
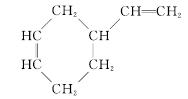
(6)A的同分异构体可以发生相同条件下的反应且产物相同,故A的同分异构体的结构简式为 CH2CH===CH2或
CH2CH===CH2或 CH2CH2CH===CH2。
CH2CH2CH===CH2。


科目:高中化学 来源: 题型:
1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应。由此可以断定原气态烃是(气体体积均在相同条件下测定) ( )
A.乙炔 B.丙炔 C.丁炔 D.1,3-丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.醛一定含有醛基,含有醛基的物质一定是醛
B.含醛基的物质都能发生银镜反应,但不一定使酸性KMnO4溶液褪色
C.醛类物质常温常压下都为液体或固体
D.含醛基的物质在一定条件下可与H2发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
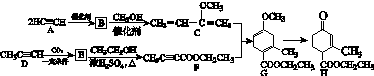
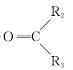
(1)A→B为加成反应,则B的结构简式是__________;B→C的反应类型是________。
(2)H中含有的官能团名称是______________________;F的名称(系统命名)是__________________________。
(3)E→F的化学方程式是__________________________。
(4)TMOB是H的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;
②存在甲氧基(CH3O—)。
TMOB的结构简式是__________________。
(5)下列说法正确的是________。
a.A能和HCl反应得到氯乙烯的单体
b.D和F中均含有2个π键
c.1 mol G完全燃烧生成7 mol H2O
d.H能发生加成反应、取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:
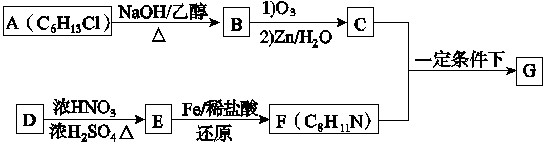
已知以下信息:
 | |||
 | |||
① 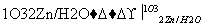 R1CHO+
R1CHO+
②1 mol B经上述反应可生成2 mol C,且C不能发生银镜反应
③D属于单取代芳烃,其相对分子质量为106
④核磁共振氢谱显示F苯环上有两种化学环境的氢
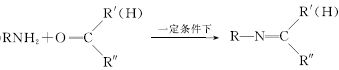 |
⑤ +H2O
回答下列问题:
(1)由A生成B的化学方程式为__________________,反应类型为________________。
(2)D的化学名称是________,由D生成E的化学方程式为________________________________________________________________________。
(3)G的结构简式为______________________________________________。
(4)F的同分异构体中含有苯环的还有________种(不考虑立体结构),其中核磁共振氢谱为4组峰,且面积比为6∶2∶2∶1的是____________(写出其中一种的结构简式)。
(5)由苯及化合物C经如下步骤可合成N异丙基苯胺。
 |
N异丙基苯胺
反应条件1所选用的试剂为________________,反应条件2所选用的试剂为______________,Ⅰ的结构简式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用食用白醋(醋酸浓度约为1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
A. 白醋中滴入石蕊试液呈红色 B. 白醋加入豆浆中有沉淀产生
C. 蛋壳浸泡在白醋中有气体放出 D. 白醋中c(H+)=0.01 moL/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A. 常温下,将pH=4的盐酸稀释1000倍后,溶液的pH=7
B. 0.10 mol/L的氨水加水稀释后,溶液中c(NH4+)·c(OH-)变大
C. 常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变
D. 若V1L pH=11的NaOH溶液与V2L pH=3的HA溶液混合后显中性,则V1≤V2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Fe(s)+CO2(g) FeO(s)+CO(g) △H=a kJ/mo1,平衡常数为K;测得在不同温度下,K值如下:
FeO(s)+CO(g) △H=a kJ/mo1,平衡常数为K;测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)若500℃时进行上述反应,CO2起始浓度为2 mol/L,CO的平衡浓度为__________。
(2)方程式中的a______________0(填“大于”、“小于”或“等于”)。
(3)700℃时,上述反应达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有________(填序号)
a. 缩小反应器体积 b. 通入CO2
c. 升高温度到900℃ d. 使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然 后再滴加1 mol/L NaOH溶液。请回答:
后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。
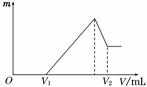
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中镁粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com