
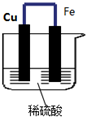
 如图所示,将铁、铜通过导线相连,置于稀硫酸中.
如图所示,将铁、铜通过导线相连,置于稀硫酸中.分析 该原电池中,Fe易失电子作负极、Cu作正极,负极上电极反应式为Fe-2e-=Fe2+,正极上电极反应式为2H++2e-=H2↑,导致负极上金属逐渐减少,正极上有气泡产生,正负极反应之和即为总反应.
解答 解:(1)该原电池中,Fe易失电子作负极、Cu作正极,负极上铁失电子发生氧化反应生成亚铁离子进入溶液,电极反应式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(2)正极上氢离子得电子发生还原反应生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)正负极反应之和即为总反应:Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑.
点评 本题考查了原电池,明确正负极的判断方法及电极上发生的反应是解本题关键,根据电极反应确定发生的现象,题目难度不大.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | X元素原子的电子层数比Y元素原子的电子层数多 | |
| B. | X的气态氢化物比Y的气态氢化物稳定 | |
| C. | X的最高价氧化物对应水化物的酸性比Y的弱 | |
| D. | Y的单质能将X从NaX溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S和NH3均是价电子总数为8的分子 | |
| B. | HS-和HCl均是含一个极性键的18电子粒子 | |
| C. | CO2的电子式为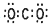 | |
| D. | 1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
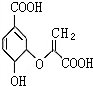 分支酸在植物的芳香族氨基酸的合成系统中作为中间体,其结构简式如图.下列关于分支酸的叙述正确的是( )
分支酸在植物的芳香族氨基酸的合成系统中作为中间体,其结构简式如图.下列关于分支酸的叙述正确的是( )| A. | 分支酸属于芳香族化合物 | |
| B. | 遇氯化铁溶液发生显色反应,可用于检验分支酸 | |
| C. | 1 mol分支酸最多可与3molH2发生加成反应 | |
| D. | 1 mol分支酸与足量NaHCO3溶液反应放出67.2L二氧化碳气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 90号汽油 | B. | 乙醇 | C. | 92号汽油 | D. | 0号汽油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com