
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | T、Q的氢化物常温常压下均为无色气体 | |
| B. | L、M的氢氧化物碱性:L>M | |
| C. | L与Q形成的化合物属于离子化合物 | |
| D. | M与T形成的化合物具有两性 |
分析 L和R的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知R为Be,L为Mg,Q和T的化合价都有-2价,应为周期表第ⅥA族元素,Q的最高价为+6价,应为S元素,T无正价,应为O元素,M的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于S,为Al元素,结合元素周期律知识解答该题.
解答 解:L和R的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知R为Be,L为Mg,Q和T的化合价都有-2价,应为周期表第ⅥA族元素,Q的最高价为+6价,应为S元素,T无正价,应为O元素,M的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于S,为Al元素,
A.T为O元素,Q为S元素,常温常压下硫化氢为无色气体,水为液体,故A错误;
B.L为Mg,M为Al元素,金属性Mg大于Al,所以L、M的氢氧化物碱性:L>M,故B正确;
C.L为Mg元素,Q为S元素,二者形成的化合物MgS为离子化合物,故C正确;
D.M为Al元素,T为O元素,二者形成化合物为氧化铝,氧化铝具有两性,故D正确,
故选A.
点评 本题考查元素位置结构性质的关系及应用,题目难度中等,关键元素化合价、原子半径推断元素是解题关键,侧重于考查学生的分析能力和对基础知识的应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| B. | 原电池就是将化学能转化为电能的装置 | |
| C. | 氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气 | |
| D. | 可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该氧化物为Fe2O3 | |
| B. | 该氧化物具有较高的熔点 | |
| C. | 该氧化物易溶于水 | |
| D. | 该氧化物能与强酸反应,但不能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳分子的比例模型 | B. | NH3的电子式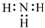 | ||
| C. | 乙烷的分子式 CH3CH3 | D. | 丙烯的结构简式 CH3CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L Na2CO3溶液中,阴离子个数等于NA | |
| B. | 标准状况下,22.4L正戊烷完全燃烧产生5NA个CO2分子 | |
| C. | 乙烯和丙烯的混合气体14g中,含有的共价键数目为3 NA | |
| D. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外每一个能层最多可容纳的电子数为n2 | |
| B. | 任一能层的能级总是从s能级开始,而且能级数等于该能层数 | |
| C. | 不同能层中s电子的原子轨道半径相同 | |
| D. | 不同能层中p电子的原子轨道能量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com