
| A. | 0.1mol•L-1KAl(SO4)2溶液中含0.2NA个SO42- | |
| B. | 常温下,9gH2O含NA个O-H键 | |
| C. | 同温同压同体积的CO2、SO2所含氧原子数均为2NA | |
| D. | 32gCu与S完全反应转移的电子数为NA |
分析 A.缺少溶液体积,无法计算溶液中硫酸根离子的数目;
B.根据n=$\frac{m}{M}$计算出水的物质的量,水分子中含有2个H-O键;
C.没有告诉二氧化碳和二氧化硫的物质的量,无法计算二者含有氧原子数;
D.铜与S反应生成的是氯化亚铜,0.5mol铜完全反应转移0.5mol电子.
解答 解:A.没有告诉该硫酸铝钾溶液的体积,无法计算硫酸根离子的物质的量及数目,故A错误;
B.9g水的物质的量为:$\frac{9g}{18g/mol}$=0.5mol,0.5mol水分子中含有1molH-O键,含NA个O-H键,故B正确;
C.缺少二氧化碳、二氧化硫的物质的量,无法计算含有的氧原子数,故C错误;
D.32g铜的物质的量为:$\frac{32g}{64g/mol}$=0.5mol,0.5molCu与S单质反应生成0.25mol氯化亚铜,转移了0.5mol电子,转移的电子数为0.5NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
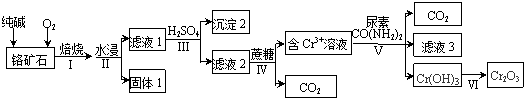
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3与过量NaOH溶液反应生成AlO${\;}_{2}^{-}$,则与过量NH3•H2O也生成AlO${\;}_{2}^{-}$ | |
| B. | Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2 | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 | |
| D. | Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
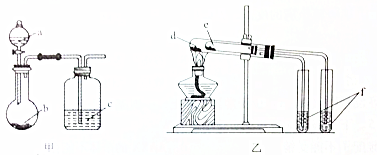
| 选项 | 实验试剂 | 实验结论 | ||
| A | a.稀硫酸 | b.碳酸氢钠 | c.硅酸钠溶液 | 酸性:硫酸>碳酸>硅酸 |
| B | a.稀盐酸 | b.二氧化锰 | c.溴化钠溶液 | 氧化性:MnO2>Cl2>Br2 |
| C | d.小苏打 | e.苏打 | f.石灰水 | 热稳定性:苏打>小苏打 |
| D | d.氯化钠 | e.氯化铵 | f.硝酸银溶液 | 沸点:氯化钠>氯化铵 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应中氯气只起氧化剂的作用 | |
| B. | 溶液Ⅰ的溶质是KClO | |
| C. | 生成反应液II中的反应氧化剂与还原剂的物质的量之比为1:1 | |
| D. | 溶液Ⅱ的溶液成分中含有K2FeO4 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:实验题
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.
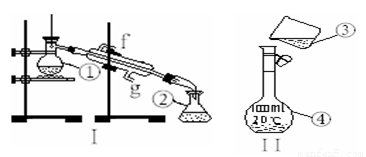
(1)写 出下列仪器的名称:① ②
出下列仪器的名称:① ②
(2)仪器①~④中,使用时必须检查是否漏水的有 .(填序号)
(3)若利用装置I分离丙三醇(能跟水、酒精以任意比互溶,沸点290℃)和酒精(沸点78.2℃)的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为; .进水方向是 (填g或f),还需加入少量碎瓷片,其作用是  .
.
(4)如图所示装置Ⅱ是转移操作,请指出该操作错误之处:
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
在相同温度和相同压强下,决定气体体积的因素主要是
A.微粒本身的大小 B.微粒的数目 C.微粒间的距离 D.微粒的种类
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com