
己二酸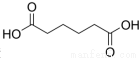 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
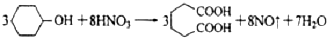
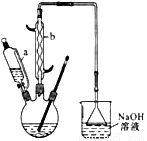
可能用到的有关数据如下:
物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
实验步骤如下:
I、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇。
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
Ⅲ、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
V、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1)滴液漏斗的细支管a的作用是_____________,仪器b的名称为_____________。
(2)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:_____________、_____________。
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则。可能造成较严重的后果,试列举一条可能产生的后果:_____________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和_____________洗涤晶体。
(5)粗产品可用_____________法提纯(填实验操作名称).本实验所得到的己二酸产率为_____________。
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:2015-2016学年湖北省黄石市高一下学期期中考试化学试卷(解析版) 题型:选择题
木炭屑与浓HNO3共热,产生的气体等分为①和②两份,将第一份气体先导入适量蒸馏水中再导入石灰水中,将第二份气体直接导入石灰水中,则石灰水的变化可能是( )
A.①不变浑浊②变乳白色 B.①变乳白色②不变浑浊
C.①变乳白色②变乳白色 D.①不变浑浊②变浅黄色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二下学期期中考试化学试卷(解析版) 题型:选择题
下面常见晶体的叙述中,错误的是( )
A.晶体硅的网状结构中,由共价键形成的硅原子环中,最小的环上有6个硅原子
B.氯化铯晶体中, Cs+的配位数为8
C.氯化钠晶体中,每个Cl-周围距离相等且最近的Cl-有6个
D.干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子有12个
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省周口市高二下学期期中考试化学试卷(解析版) 题型:选择题
为了鉴定氯乙烷中氯元素的存在,以下各步实验:①加入AgNO,溶液 ②加入NaOH的醇溶液, ③加热 ④用HNO3酸化溶液 ⑤加人NaOH的水溶液,其中操作顺序合理的是
A.①②③⑤ B.②③④① C.④③⑤① D.⑤③④①
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省周口市高二下学期期中考试化学试卷(解析版) 题型:选择题
将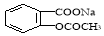 转变为
转变为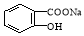 的方法为
的方法为
A.与足量的NaOH溶液共热后,再通入CO2
B.与氢氧化钠溶液热,通入足量的HCl
C.与稀H2SO4共热后,加入足量的Na2CO3
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三第二轮训练五化学试卷(解析版) 题型:选择题
组成和结构可用 表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )
A.16种 B.28种 C.48种 D.60种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高二下第十二周练化学卷(解析版) 题型:填空题
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途。请回答下列问题:
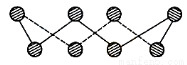
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 ;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(3)Se原子序数为 ,其核外M层电子的排布式为 ;
(4)H2Se的酸性比H2S (填“强”或“弱”)。气态SeO3分子的立体构型为 ,SO32-离子的立体构型为 ;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
;
② H2SeO4比 H2SeO3酸性强的原因:
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高二下第十二周练化学卷(解析版) 题型:选择题
下列说法正确的是
A.HF、HCl、HBr、HI的熔沸点依次升高
B.乙醇分子与水分子之间只存在范德华力
C.H2O的熔点、沸点大于H2S是由于H2O分子之间存在氢键
D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中理科化学试卷(解析版) 题型:选择题
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为

A.1:1 B.2:3 C.3:2 D.2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com