


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
(15分)氯化铁是常见的水处理剂,无水氯化铁的熔点为555K、沸点为588K。工业制备氯化铁的一种工艺如下:
回答下列问题
(1)取0.5mL氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为 。
(2)已知FeCl3·6H2O在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是 。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的化学式为 。
(4)室温时向FeCl3溶液中滴加NaOH溶液,当溶液中c(Fe3+)≤1.0×10-5 mol·L-1时,视作Fe3+沉淀完全,则Fe3+沉淀完全的pH至少为 (已知Ksp[Fe(OH)3]=1.0×10-38)。
(5)吸收剂X是 ,吸收塔中吸收剂X的作用是 。
(6)测定样品中FeCl3的质量分数的方法是:
a.称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容
b.取出10mL待测溶液于锥形瓶中,加入稍过量的KI溶液充分反应
c.以淀粉作指示剂,用b mol·L-1Na2S2O3溶液滴定(I2+2 Na2S2O3=Na2S4O6+2NaI),共用去VmL。①样品中氯化铁的质量分数为 。
②若用上述办法测定的样品中FeCl3的质量分数偏低(测定过程中产生的误差可忽略),其原因可能是 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省淮阴中学、海门中学、天一中学高三上学期联考化学试卷 题型:填空题
(15分)氯化铁是常见的水处理剂,无水氯化铁的熔点为555K、沸点为588K。工业制备氯化铁的一种工艺如下:
回答下列问题
(1)取0.5mL氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为 。
(2)已知FeCl3·6H2O在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市十二区县重点校高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。
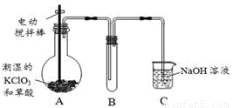
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:??????????????????????????? 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、??????????????? ;
B装置必须放在冰水浴中,其原因是??????????????????????????????? 。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:①???????????????????? ;②??????????????????? ;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2 =Na2S4O6 + 2NaI)
①配制100 mL c mol/LNa2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:???????????????????????? 。
②滴定过程中至少需进行两次平行测定的原因是???????????????????????????????? 。
③写出步骤2中发生反应的离子方程式?????????????????????????????????? 。
④原ClO2溶液的浓度为???????????????? g / L(用步骤中的字母代数式表示)。
⑤若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果????????????? 。
若滴定开始仰视读数,滴定终点时正确读数,则测定结果?????????????????? 。
(填“偏高”“偏低”或“不变” )
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省、海门中学、天一中学高三上学期联考化学试卷 题型:填空题
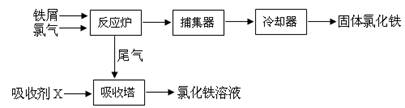
(15分)氯化铁是常见的水处理剂,无水氯化铁的熔点为555K、沸点为588K。工业制备氯化铁的一种工艺如下:
回答下列问题
(1)取0.5mL氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为 。
(2)已知FeCl3·6H2O在水中的溶解度如下:
|
温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
|
溶解度(g/100gH2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是 。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的化学式为 。
(4)室温时向FeCl3溶液中滴加NaOH溶液,当溶液中c(Fe3+)≤1.0×10-5 mol·L-1时,视作Fe3+沉淀完全,则Fe3+沉淀完全的pH至少为 (已知Ksp[Fe(OH)3]=1.0×10-38)。
(5)吸收剂X是 ,吸收塔中吸收剂X的作用是 。
(6)测定样品中FeCl3的质量分数的方法是:
a.称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容
b.取出10mL待测溶液于锥形瓶中,加入稍过量的KI溶液充分反应
c.以淀粉作指示剂,用b mol·L-1Na2S2O3溶液滴定(I2+2 Na2S2O3= Na2S4O6+2NaI),共用去VmL。①样品中氯化铁的质量分数为 。
②若用上述办法测定的样品中FeCl3的质量分数偏低(测定过程中产生的误差可忽略),其原因可能是 。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
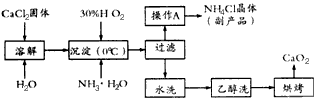
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com