
����Ŀ��Cu3N�������õĵ�ѧ��ѧ�����ڵ��ӹ�ҵ�����պ�������������ͨѶ�����Լ���ѧ���̵������У������Ź㷺�ġ���������ľ����á�
��1��C��N��O����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ__��
��2����N3-������ͬ����������ԭ�����Ŀռ乹����__��
��3��Cu+�ĵ����Ų�ʽΪ__������������Һ�в��ȶ����ɷ����绯��Ӧ����Cu2+��Cu����CuO�ڸ����»�ֽ��Cu2O���Դӽṹ�ǶȽ�������CuOΪ�λ�����Cu2O��__��
��4����Cu�Ĵ������£��Ҵ��ɱ���������Ϊ��ȩ����ȩ������̼ԭ�ӵ��ӻ���ʽ��__����ȩ����H-C-O�ļ���_(����������������������С����)�Ҵ������е�H-C-O�ļ��ǡ�
��5��[Cu(H2O)4]2+Ϊƽ�������νṹ�����е�����H2O��Cl-ȡ�������ֲ�ͬ�Ľṹ���Ի���Cu(H2O)2Cl2���м��Եķ��ӵĽṹʽ��___��
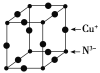
��6��Cu3N�ľ����ṹ��ͼ��ʾ��N3-����λ��Ϊ__��Cu+�İ뾶Ϊapm��N3-�İ뾶Ϊbpm��Cu3N���ܶ�Ϊ__g��cm-3(�����ӵ�������NA��ʾ)��
��7����(N2H4)�ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���������ȼ�ϵ����һ�ּ���ȼ�ϵ�أ���������Ⱦ���������Һ��20%��30%��KOH��Һ����������ȼ�ϵ�طŵ�ʱ�������ĵ缫��Ӧʽ��__��
��8���������۷ɴ��ij����������(N2H4����̬)Ϊȼ�ϣ�Ϊ�������(N2H4)ȼ�չ������ͷŵ�����������NO2������������O2�������߷�Ӧ����N2��ˮ������
��֪����N2(g)+2O2(g)=2NO2(g) ��H1=+67.7kJ��mol-1����N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H2=-534kJ��mol-1��д���º�NO2��ȫ��Ӧ���Ȼ�ѧ����ʽ��__��
���𰸡�N>O>C V�� 1s22s22p63s23p63d10(��[Ar]3d10) Cu+��3d����ϵ���ȫ��������ṹ�ȶ� sp3��sp2 ���� 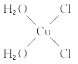 6
6 ![]() g/cm3 N2H4-4e-+4OH-=N2+4H2O 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ��H=-1135.7kJ��mol-1
g/cm3 N2H4-4e-+4OH-=N2+4H2O 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ��H=-1135.7kJ��mol-1
��������
(1)ͬ����������ҵ�һ�����ܳ��������ƣ�NԪ��ԭ�ӵ�2p�ܼ���3�����ӣ�Ϊ������ȶ�״̬���������ͣ�ʧȥ��һ��������Ҫ�������ϸߣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������N>O>C��
(2)��N3-������ͬ����������Ϊ�ȵ����壬��NO2-���ȵ�����ṹ���ƣ��������������Nԭ�Ӽ۲���ӶԸ���=2+1/2(5+1-2��2)=3�Һ���һ���µ��Ӷԣ�����ΪV�νṹ��
(3)Cu+�ĺ�����28�����ӣ����ݹ���ԭ��֪���̬���Ӻ�������Ų�ʽ1s22s22p63s23p63d10��ԭ�ӹ������ȫ�ա��������ȫ����ʱ���ȶ���Cu+��3d�����ȫ�������ȶ���
(4)��ȩ�����м���̼ԭ�Ӻ���4��������ȩ���ϵ�̼ԭ�Ӻ���3�����������Լ��е�̼ԭ�Ӳ���sp3�ӻ���ȩ���е�̼ԭ�Ӳ���sp2�ӻ����Ҵ��к��д��ǻ���̼ԭ�Ӳ���sp3�ӻ���������ȩ������H-C-O�ļ��Ǵ����Ҵ������е�H-C-O�ļ��ǣ�
(5)[Cu(H2O)4]2+Ϊƽ�������νṹ�����е�����H2O��Cl-ȡ�������ֲ�ͬ�Ľṹ��[Cu(H2O)2(Cl)2]���м��Եķ��ӣ�˵���÷��ӵĽṹ���Գƣ�����ṹʽΪ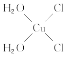 ��
��
(6)Cu3N�ľ����ṹ��ͼ���������=12��![]() =3��С�����=
=3��С�����=![]() ��8=1�����Դ����ʾCuԭ�ӡ�С���ʾNԭ�ӣ�N3-����λ��=3��2=6�����������=[(2a+2b)��10-10cm]3��Cu3N���ܶ�=
��8=1�����Դ����ʾCuԭ�ӡ�С���ʾNԭ�ӣ�N3-����λ��=3��2=6�����������=[(2a+2b)��10-10cm]3��Cu3N���ܶ�=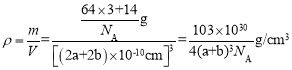 ��
��
(7)ԭ����и���ʧ���ӷ���������Ӧ�������Ŀ��Ϣ��֪��������ȼ�ϵ�طŵ�ʱ�±��������ɵ��������Ը�����Ӧ����ʽΪ��N2H4-4e-+4OH-=N2+4H2O��
(8)�º�NO2��ȫ��Ӧ�ķ���ʽΪ��2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)����֪����N2(g)+2O2(g)=2NO2(g) ��H1=+67.7kJ��mol-1����N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H2=-534kJ��mol-1����Ӧ����2-�ٿɵ��º�NO2��ȫ��Ӧ�ķ���ʽ�����ݸ�˹���ɸ÷�Ӧ��H=-534kJ��mol-1��2-67.7kJ��mol-1=-1135.7kJ��mol-1�������º�NO2��ȫ��Ӧ���Ȼ�ѧ����ʽΪ��2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ��H=-1135.7kJmol-1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�����������Ӧ���������ܴ���������ǣ� ��
A.��ˮ���������c(H+)=1��10-10molL-1����Һ�У�NO3-��Fe2+��Na+��SO42-
B.![]() =10-10molL-1����Һ�У�NH4+��I-��Cl-��K+
=10-10molL-1����Һ�У�NH4+��I-��Cl-��K+
C.![]() =1��106����Һ�У�K+��Na+��Cl-��HCO3-
=1��106����Һ�У�K+��Na+��Cl-��HCO3-
D.���Ե缫���AgNO3�����Һ�У�SO32-��K+��Na+��S2-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ��仯�����ڻ������ɵ�����Ӧ�ù㷺����ҵβ���е�SO2һֱ�ǻ�����Ⱦ����Ҫԭ��֮һ��
I��SO2β���Ĵ���
����1��ȼú�м�����ʯ�ң���SO2ת��ΪCaSO3��������ΪCaSO4
��֪��a��CaO(s)+CO(g) = CaCO3(s) ��H= 178.3kJ��mol1
b��2CaCO3(s)+2SO2(g)+O2(g)= 2CaSO4(s)+2CO2(g) ��H= 2762.2kJ��mol1
c��2CaSO3(s)+O2(g)= 2CaSO4(s) ��H= 2314.8kJ��mol1
��1��д��CaO(s)��SO2(g)��Ӧ����CaSO3(s)���Ȼ�ѧ����ʽ��___��
����2���ð�ˮ��SO2ת��ΪNH4HSO3��������Ϊ(NH4)2SO4��
��2��ʵ����NH4HSO3��Һ��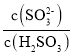 =1500������Һ��pHΪ________(��֪��H2SO3��Ka1=1.5��102��Ka2=1��0��107��K(NH3��H2O)=1.74��10��5��)��NH4HSO3��Һ����������Ũ�ȴ�С��ϵ��ȷ����_____��
=1500������Һ��pHΪ________(��֪��H2SO3��Ka1=1.5��102��Ka2=1��0��107��K(NH3��H2O)=1.74��10��5��)��NH4HSO3��Һ����������Ũ�ȴ�С��ϵ��ȷ����_____��
A c(NH4+)>c(HSO3��)>c(H+)>c(SO32)>c(OH��)
B c(HSO3��)>c(NH4+)>(SO32��)>c(H+)>c(OH��)
C c(NH4+)+c(NH3��H2O)=c(HSO3��)+2c(SO32)+c(H2SO3)
D c(H+)+c(H2SO3)=c(OH��)+c(SO32)+c(NH3��H2O)
II��SO2�Ļ������ã�
��3��SO2��Cl2��Ӧ���Ƶû�����(SO2Cl2)����ӦΪSO2(g)��Cl2(g)![]() SO2Cl2(g)����Ͷ�ϱ�1:1��SO2��Cl2����һ��ѹ���ܱ������з���������Ӧ��SO2��ת�������¶�T�Ĺ�ϵ����ͼ��ʾ��
SO2Cl2(g)����Ͷ�ϱ�1:1��SO2��Cl2����һ��ѹ���ܱ������з���������Ӧ��SO2��ת�������¶�T�Ĺ�ϵ����ͼ��ʾ��
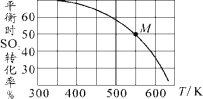
�ٺ��º�ѹ�����£��ܱ������з���������Ӧ��������ʵ����˵����Ӧ�ﵽƽ��״̬����_______(����ĸ)��
a SO2Cl2��Ũ�ȱ��ֲ��� b ��������ѹǿ���ٸı�
c ���������ܶȲ��ٸı� d ��������ƽ����Է����������ٸı�
������Ӧһֱ������pѹǿ�����½��У���M��ķ�ѹƽ�ⳣ��Kp��_____(�ú�p�ı���ʽ��ʾ����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ���������)��
III����4����������(H2S2O8)��һ��ǿ�������ᣬ��ṹʽΪ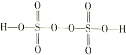 ���ڹ�ҵ������ǿ��������
���ڹ�ҵ������ǿ��������
����Ag+�������£�S2O82����Mn2+��ˮ��Һ�з�����Ӧ����SO42��MnO4��1molS2O82��������Mn2+�����ʵ���Ϊ_________mol��
�ڹ�ҵ�Ͽ��ö��Ե缫������������炙����Һ�Ʊ���������李��������ĵ缫��ӦʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ŷ����λ��ѧ���������ӻ����������ϳ����о����ٻ�2016��ŵ������ѧ���������ӻ����о������г������������������������ͼ��ʾ������˵����ȷ����

A. �٢ۻ�Ϊͬϵ�� B. �٢ڢܾۢ�������
C. �٢ܵ�һ�ȴ����Ϊ���� D. �ڢܻ�Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֶ�����Ԫ�أ����ǵĽṹ�����ʵ���Ϣ���±���ʾ��
Ԫ�� | �ṹ�����ʵ���Ϣ |
A | �Ƕ�����Ԫ�أ�ϡ������Ԫ�س��⣩��ԭ�Ӱ뾶����Ԫ�أ�����Ԫ�ص�ij�ֺϽ���ԭ�ӷ�Ӧ�ѵĵ��ȼ� |
B | ��Aͬ���ڣ�������������Ӧ��ˮ��������� |
C | ����̬�⻯�K������ˮ��Һ̬ʱ����������� |
D | �Ǻ�ˮ�г��⡢��Ԫ���⺬������Ԫ�أ��䵥�ʻ���Ҳ������ˮ���������г��õ�ɱ�������� |
E | Ԫ��ԭ�ӵ�L���Ӳ�����2�ԳɶԵ��� |
����ݱ�����Ϣ�ش��������⡣
��1��AԪ��ԭ�ӵĺ�������Ų�ʽΪ___��
��2��BԪ����Ԫ�����ڱ��е�λ��Ϊ___�����Ӱ뾶��B___�������������A��
��3��CԪ��ԭ�ӵĹ����ʾʽΪ___����ԭ�Ӻ�����___��δ�ɶԵ��ӣ�������ߵĵ����Ų��ڹ���ϣ��ù����___�Ρ�
��4��DԪ��ԭ�ӵĺ�������Ų�ʽΪ___��D-�Ľṹʾ��ͼΪ___��
��5��C��EԪ�صĵ�һ�����ܵĴ�С��ϵ��___����Ԫ�ط��ű�ʾ����
��6����֪CD3������DԪ����+1�ۣ��������£�C��DԪ�صĵ縺�Դ�С��ϵ��CD3___����Ԫ�ط��ű�ʾ����CD3��ˮ��Ӧ��IJ�����___���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ����
A. ��������������������Һ��Ӧ��CH3COOCH2CH3��OH��CH3COO+CH3CH2O+H2O
B. ������Һ������������ͭ��Ӧ��2H+��Cu(OH)2��Cu2+��2H2O
C. ��������Һ��ͨ������������̼��2![]() ��CO2��H2O
��CO2��H2O![]() 2
2![]() ��CO
��CO![]()
D. ��ȩ��Һ������������ͭ��������Һ����CH3CHO+2Cu(OH)2+OH![]() CH3COO+ Cu2O��+3H2O
CH3COO+ Cu2O��+3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�ҷ�����һ�����ɹ̵�����ﮣ������ε�أ��ÿɴ��� Li+����������������ʣ���ص��ܷ�ӦΪ6Li +N2 ![]() 2Li3N������˵����ȷ����
2Li3N������˵����ȷ����
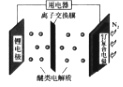
A.�̵�ʱ������ת��Ϊ��ѧ��
B.�̵�ʱ��������﮵缫���õ��������ɸ��ϵ缫
C.�ѵ�ʱ���ɸ��ϵ缫�ĵ缫��Ӧ�� 2Li3N - 6e- =6 Li++N2��
D.�ѵ�ʱ ��Li+���ɸ��ϵ缫Ǩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪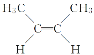 ��
��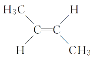 �ǻ�Ϊ��˳���칹����ͬ���칹�壬�л�������C4H8�������е���Ҫ���ʣ�����C4H8��˵���У�������ǣ� ��
�ǻ�Ϊ��˳���칹����ͬ���칹�壬�л�������C4H8�������е���Ҫ���ʣ�����C4H8��˵���У�������ǣ� ��
A.C4H8������ϩ��
B.C4H8������ϩ����ͬ���칹����4��(��˳���칹)
C.C4H8������ϩ����˳���칹����2��
D.�˴Ź���������2�����շ��ϩ���ṹһ����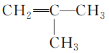
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷Ͼɶ�п��Ƥ���Ʊ�����Fe3O4�������Ӳ��õ�������ZnO���Ʊ�������ͼ��ʾ��(��֪ZnO������ǿ��)
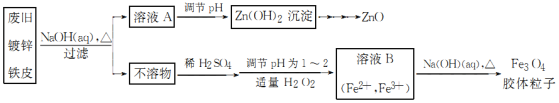
��֪��Zn���仯�����������Al���仯������������ơ���ش��������⣺
��1����NaOH��Һ�����Ͼɶ�п��Ƥ��Ŀ����________������ĸ����
A ȥ������ B �ܽ��п��
C ȥ������ D �ۻ���Ƥ
��2��������ҺA��pH�ɲ���Zn(OH)2������Ϊ�Ƶ�ZnO���������������dz���______��
��3��������H2O2 Ŀ����________ ��ҺB�Ƶ�Fe3O4�������ӵĹ����У������ͨ��N2����ԭ����_____��
��4��������ZnO�������Ʊ�п���ʡ��ҹ�������п�����ļ��أ�������Ӧ�����ġ��칤������С�������Ǧ���ļ��أ���ÿ¯��ʯʮ�װ����һ���������Ȼ�������ú̿����ʢ�������н�������Ѻ��䶨�ٹ�ȡ��������ǦҲ��������п���չ����漰��Ҫ��Ӧ�Ļ�ѧ����ʽΪ_________����ע��¯��ʯ����Ҫ�ɷ�Ϊ̼��п������Ǧ����ָ����п����
��5�����ظ���ط�(һ��������ԭ�ζ���)�ɲⶨ����Fe3O4�еĶ�������������������Ũ��Ϊ0.01 mol��L��1��K2Cr2O7����Һ250 mL��Ӧȷ��ȡ________g K2Cr2O7[����4λ��Ч���֣���֪Mr(K2Cr2O7)��294]�����Ƹñ���Һʱ�������������ò�������________�����ţ���
�ٵ�����ƽ�����ձ�������Ͳ���ܲ���������250 mL����ƿ����ͷ�ιܡ�����Һ��
��6���ζ������У�����ζ�ǰװ��K2Cr2O7����Һ�ĵζ��ܼ��첿�������ݣ����ζ�������������ʧ����ⶨ�����________(�ƫ��ƫС�����䡱)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com