
【题目】制备硅单质时,主要化学反应如下:
(1)SiO2+2C ![]() Si+2CO↑
Si+2CO↑
(2)Si+2Cl2 ![]() SiCl4
SiCl4
(3)SiCl4+2H2 ![]() Si+4HCl
Si+4HCl
下列对上述三个反应的叙述中,不正确的是( )
A.(1)(3)为置换反应
B.(1)(2)(3)均为氧化还原反应
C.(2)为化合反应
D.三个反应的反应物中硅元素均被还原
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】已知X,Y,Z,W(含同一元素)有如转化关系,若X是一种单质,W为一种含氧酸,则X不可能是( )
X ![]() Y
Y ![]() Z
Z ![]() W.
W.
A.N2
B.C
C.S
D.Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )

A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在一定条件下不能实现的是
A. Al2O3→Al(OH)3→Al B. Cu→CuO→CuSO4
C. Na→NaOH→Na2CO3 D. Fe(OH)3→Fe2O3→Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式不正确的是
A. 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O
B. 在燃煤中加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2
C. 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4
D. 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生可逆反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol/L,则此时v(正)<v(逆)
C. 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D. 恒温时将气体体积缩小到原来的一半,达到新平衡时CO浓度将要减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液.只用一种试剂就能加以区别,这种试剂是
A. KSCN B. BaCl2 C. NaOH D. HCI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为______________。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) ![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是____(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是____。
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1molCO2生成的同时有3mol H-H键断裂
(2)产物甲醇可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是____________。
(3)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) 其平衡常数表达式为_____________________________。
CH4(g)+2H2O(g) 其平衡常数表达式为_____________________________。
向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,300℃时发生上述反应,达到平衡时各物质的浓度分别为:CO2:0.2 mol·L一1,H2:0.8 mol·L一1,CH4:0.8 mol·L一1,
H2O:1.6 mol·L一1。
则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=___________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____ O (填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列方法测定某水样中O2的含量。
(1)实验原理。
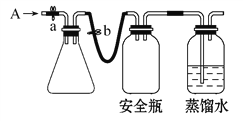
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为____________________________。
②在酸性条件下,再用I-将生成的MnO(OH)2还原为Mn2+,反应的离子方程式为____________________。然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为I2+2Na2S2O32NaI+Na2S4O6。
(2)实验步骤。
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是_________;
②用注射器抽取某水样20.00 mL从A处注入锥形瓶;
③再分别从A处注入含mmol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及一定浓度的硫酸(含H2SO4nmol);
⑥重复④的操作;
⑦取下锥形瓶,向其中加入2~3滴__________作指示剂;
⑧用0.005 mol·L-1Na2S2O3溶液滴定至终点。滴定终点的现象是_____________。
(3)数据分析。
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________mg·L-1。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将__________(填“偏大”“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com