
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
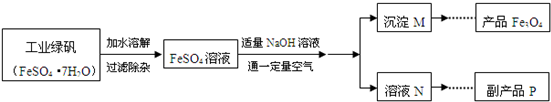
(14分) 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
已知:①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③ 12.16﹡1000﹡52.5%=6384, 6384/152=42请回答下列问题:
(1)铁的常见氧化物有 ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ,检验反应后的溶液中含Fe3+的方法 ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是: ;
(4)生产中可获得的副产品是 ,提取该副产品的操作顺序是 (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为 L/h(假设反应在标准状态下进行,空气中O2占20%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分). 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③ 12.16﹡1000﹡52.5%=6384, 6384/152=42请回答下列问题:
(1)铁的常见氧化物有 ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ,检验反应后的溶液中含Fe3+的方法 ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是: ;
(4)生产中可获得的副产品是 ,提取该副产品的操作顺序是 (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为 L/h(假设反应在标准状态下进行,空气中O2占20%)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三模拟考试理科综合化学试卷(解析版) 题型:填空题
(14分) 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:

已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③ 12.16﹡1000﹡52.5%=6384, 6384/152=42请回答下列问题:
(1)铁的常见氧化物有 ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ,检验反应后的溶液中含Fe3+的方法 ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是: ;
(4)生产中可获得的副产品是 ,提取该副产品的操作顺序是 (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为 L/h(假设反应在标准状态下进行,空气中O2占20%)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:填空题
(14分). 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:

已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③ 12.16﹡1000﹡52.5%=6384, 6384/152=42请回答下列问题:
(1)铁的常见氧化物有 ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ,检验反应后的溶液中含Fe3+的方法 ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是: ;
(4)生产中可获得的副产品是 ,提取该副产品的操作顺序是 (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为 L/h(假设反应在标准状态下进行,空气中O2占20%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com