
【题目】下列有关硅及其化合物的描述不正确的是
A. SiO2可用于制造光导纤维 B. H2SiO3可以用二氧化硅和水反应制得
C. 普通玻璃是以纯碱、石灰石和石英为原料制成的 D. 盛装NaOH溶液的试剂瓶不用玻璃塞的原因是因为玻璃塞与NaOH溶液反应
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】氧和钠能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_______;晶胞中氧原子的配位数为________;列式计算晶体F的密度(g·cm-3)________。
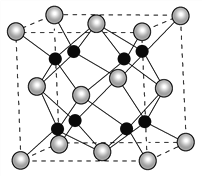
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果发现了原子序数为116的元素,下列叙述不正确是
①位于第七周期;
②是非金属元素;
③最外电子层含有6个电子;
④没有放射性;
⑤属于氧族元素;
⑥属于卤素。
A. ②④⑥ B. ①③⑥ C. ①③⑤ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某元素的原子序数是30,下列关于该元素的说法正确的是 ( )
A.基态原子的价电子排布式为4S2B.位于第四周期ⅡA族
C.属于过渡金属元素D.最高化合价为+3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。

(1)填充物用60℃温水溶解,目的是_________。
(2)铜帽溶解完全后,可采用______方法除去溶液中过量的H2O2。
(3)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。其正极的电极反应式为______________。
(4)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率_______。
②在pH为12~14条件下,KMnO4溶液吸收Hg的化学方程式________。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀破酸、稀草酸,并不断搅拌至无气泡为止。主要反应为: 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1mol MnO(OH)参加反应时,共有______mol电子发生转移。
②已知:MnCO3和Mn(OH)2的Ksp分别是9×10-11、4×10-14。工业上向上述所得的MnSO4溶液中加入NH3和NH4HCO3来制备碳酸锰, 若溶液中Mn2+为1.0mol·L-1,为尽可能多的获得高纯碳酸锰,应控制溶液中c(CO32-)_______≥mol·L-1,过程中应控制pH<_______。[Mn2+沉淀完全;lg2=0.3]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________________________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碳和硅的叙述,正确的是
A. 其单质在加热时都能跟氧气反应
B. 其氧化物都能跟氢氧化钠溶液反应
C. 其含氧酸可由相应的氧化物溶于水得到
D. 其单质化学性质稳定,都能以游离态存在于自然界中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,天津连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害。研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是___。
②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显______性(填“酸”、“碱”或“中”),用化学平衡原理解释:__________。
③当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:

写出HSO3-在阳极放电的电极反应式:____________,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。
(2)用CH4催化还原NO2可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g); ΔH=-574 kJ mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g):ΔH=-1160 kJ mol-1
若用标准状况下4.48 L CH4还原 NO2至N2,整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
(3)工业上合成氨所需氢气的制备过程中,其中的一步反应为:
CO(g) + H2O(g) ![]() CO2(g) + H2(g): ΔH<0
CO2(g) + H2(g): ΔH<0
—定条件下,将CO(g)与H2O(g)以体枳比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为丨:6,则平衡常数K=__________(计算结果保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com