
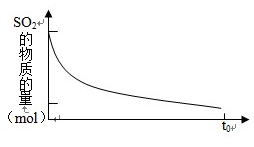
 将2mol SO2和1mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0,当反应进行到时间t0点时达到平衡状态,测得混合气体的总物质的量为2.1mol.试回答:
将2mol SO2和1mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0,当反应进行到时间t0点时达到平衡状态,测得混合气体的总物质的量为2.1mol.试回答:| c 2 ( SO3 ) |
| c2 ( SO2 ) ? c ( O2 ) |
| c 2 ( SO3 ) |
| c2 ( SO2 ) ? c ( O2 ) |
| c 2 ( SO3 ) |
| c2 ( SO2 ) ? c ( O2 ) |
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
| 0.2 |
| 2.1 |
 ,
, ;
;| c 2 ( SO3 ) |
| c2 ( SO2 ) ? c ( O2 ) |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化钠的水解反应:S2-+H3O+?HS-+H2O | ||||
B、用铜做阳极电解氯化铜溶液:Cu2++2Cl-
| ||||
| C、在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O | ||||
| D、在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z、M、Q均为除稀有气体外分布在3个不同短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,X、M在周期表中位置如图所示.
W、X、Y、Z、M、Q均为除稀有气体外分布在3个不同短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,X、M在周期表中位置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B、AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C、温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 |
| D、将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知KMnO4和H2C2O4(草酸)在酸性溶液中会发生如下反应:
已知KMnO4和H2C2O4(草酸)在酸性溶液中会发生如下反应:| 序号 | A溶液 | B溶液 |
| ① | 2mL0.1mol?L-1 H2C2O4溶液 |
4mL0.01mol?L-1 KMnO4溶液 |
| ② | 2mL0.2mol?L-1 H2C2O4溶液 |
4mL0.01mol?L-1 KMnO4溶液 |
| ③ | 2mL0.2mol?L-1 H2C2O4溶液 |
4mL0.01mol?L-1 KMnO4溶液 少量MnSO4(催化剂) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Na+2H2O=2NaOH+H2↑ | ||||
| B、Fe+2FeCl3=3FeCl2 | ||||
C、CaCO3
| ||||
D、Fe2O3+3CO
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com