
 如右图,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压)当取下K夹,使两烧瓶内气体充分接触后容器内压强由小到大的顺序正确的是( )
如右图,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压)当取下K夹,使两烧瓶内气体充分接触后容器内压强由小到大的顺序正确的是( )
| 编号 | ① | ② | ③ | ④ |
| A中气体 | H2S | H2 | NH3 | NO |
| B中气体 | SO2 | Cl2 | HCl | O2 |
A、②③④① B、③①④② C、③②①④ D、④③②①
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源:2010年山东省潍坊市高三上学期开学摸底考试化学试题 题型:填空题
(10分)CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g) 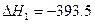 kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g) 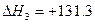 kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的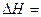 。
。
(2)在10L密闭容器中充有10 molCO 与20molH2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) 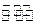 CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率( )与温度、压强的关系如右图所示。
)与温度、压强的关系如右图所示。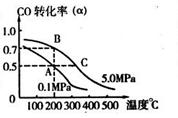
①若A、B两点表示在某时刻达到的平衡状态,则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g) ![]() kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g) ![]() kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的![]() 。
。
(2)在10L密闭容器中充有10 molCO 与20molH2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率(![]() )与温度、压强的关系如右图所示。
)与温度、压强的关系如右图所示。
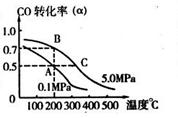
①若A、B两点表示在某时刻达到的平衡状态,则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C三种短周期元素在周期表中相对位置如右图:
![]() (1)A与C形成的液态化合物是常见的重要有机溶剂,则A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:
(1)A与C形成的液态化合物是常见的重要有机溶剂,则A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:
_________>_________>___________(用化学式表示)。
(2)X、Y为B、C两种元素形成的单质。标准状况下,X的密度为3.17 g/L。Z是一种化合物,焰色反应呈紫色(透过钴玻璃),室温下0.1 mol/L Z水溶液pH=13。X、Y、Z有如图转化关系:
![]()
①写出X与Z反应的离子方程式:_____________________________
②已知丙能与稀硫酸反应生成使品红褪色的气体。
丁的化学式_______,丁的水溶液pH>7的原因:
___________________________________(用离子方程式表示)
③将20 mL 0.5 mol/L丙溶液逐滴加入20 mL 0.2 mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
高氯酸钾广泛用于火箭及热电池业。实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到。
(1)写出实验室制取高氯酸钾的化学方程式:___ _。
(2)用蒸馏水多次洗涤晶体的目的是______________ __。
(3)称取29.8gKCl和34.0gNaNO3放入250mL烧杯中,再加入70.0g蒸馏水,制备KNO3晶体, I、使固体全部溶解。II、在100oC时蒸发掉50.0g水,维持该温度,趁热过滤析出晶体![]() 。III、冷却结晶:待滤液冷却至室温(实验时室温为10oC)后,进行减压过滤。得KNO3粗产品
。III、冷却结晶:待滤液冷却至室温(实验时室温为10oC)后,进行减压过滤。得KNO3粗产品![]() 。IV、重结晶得KNO3纯品
。IV、重结晶得KNO3纯品![]() 。
。
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10oC | 80.5 | 20.9 | 35.7 | 31.0 |
| 100oC | 175 | 246 | 39.1 | 56.6 |
①操作III中采用减压过滤,装置如右图所示,仪器A和B的名称分别是
,
②该装置有三处错误,分别是
,
③若实验过程中发现倒吸现象,应采取的措施是 。
(4) KNO3晶体纯品的产率 。 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com