
【题目】有下列物质:①Fe ②CO2 ③H2SO4 ④Ba(OH)2溶液 ⑤NaCl 其中属于酸的是___(填序号,下同),属于碱的是___,属于盐的是____,属于氧化物的是____。
科目:高中化学 来源: 题型:
【题目】下列式子正确且属于水解反应,溶液又呈碱性的是
A. HCO3-+H2O![]() H3O++CO32- B. Fe3++3H2O
H3O++CO32- B. Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
C. HS-+H2O![]() H2S+OH- D. CO32-+H2O
H2S+OH- D. CO32-+H2O![]() H2CO3+OH-
H2CO3+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中错误的是( )
A. Na2CO3=Na2++CO32- B. Na2SO4=2Na++SO42-
C. Ba(OH)2=Ba2++2OH- D. MgCl2=Mg2++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
Ⅰ催化还原法
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ/mol
则CH4将NO2还原为N2的热化学方程式为____________________________。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) ΔH < 0。为提高氮氧化物的转化率可采取的措施是_______________(写出1条即可)。
2N2(g)+3H2O(g) ΔH < 0。为提高氮氧化物的转化率可采取的措施是_______________(写出1条即可)。
(3)在汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质。主要反应如下:2NO(g)+ 2CO(g)![]() N2(g)+ 2CO2(g)。在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,发生上述反应,10分钟时反应达到平衡状态,此时容器中CO变为0.6molL-1。
N2(g)+ 2CO2(g)。在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,发生上述反应,10分钟时反应达到平衡状态,此时容器中CO变为0.6molL-1。
①前10分钟内用氮气表示的反应速率为___________,计算该温度下反应的平衡常数K为______Lmol-1。(只列算式,不要求计算结果)
②若保持温度不变,在15分钟时向容器内再次充入NO 1.6 mol、CO2 0.4 mol,则此时反应的ν正___ν逆(填“<”、“=”或“> ”)
II 氧化法。
(4)首先利用ClO2 氧化氮氧化物,再利用还原剂还原为无毒的氮气。其转化流程如下:
NO![]() NO2
NO2![]() N2。
N2。
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是_____________________________;若生成11.2 L N2(标准状况),则消耗ClO2____________g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置_________。
(2)配合物Fe(CO)n常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)n晶体属于______(填晶体类型)。Fe(CO)n的中心原子价电子数与配体提供电子数之和为18,则n=______ 。Fe(CO)n在一定条件下发生反应:Fe(CO)n(s)![]() Fe(s)+ n CO(g)。已知反应过程中只断裂配位键,则该反应生成物中新形成的化学键类型为___________。
Fe(s)+ n CO(g)。已知反应过程中只断裂配位键,则该反应生成物中新形成的化学键类型为___________。
(3)K3[Fe(CN)6]溶液可用于检验________(填离子符号)。CN-中碳原子杂化轨道类型为_________,C、N、O三元素的第一电离能由大到小的顺序为_______(用元素符号表示)。
(4)铜晶体的晶胞如右图所示。
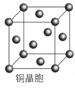
①基态铜原子的核外电子排布式为________________。
②每个铜原子周围距离最近的铜原子数目________。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子)。
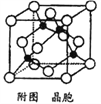
①该晶体的化学式为____________。
②已知该晶体的密度为g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为_________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 氨水中加酸,NH4+ 的浓度增大
B. 装有NO2和N2O4平衡的混合气体的玻璃球在冷水中气体颜色变浅
C. 实验室中常用排饱和食盐水的方法收集Cl2
D. H2、I2、HI的体系平衡后,加压混合气体颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
A. 氧化铁是一种碱性氧化物,常用作红色油漆和涂料
B. 在医疗上碳酸钠、氢氧化铝均可用于治疗胃酸过多
C. Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
D. 人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在400℃、101 kPa时,NO2(g) +CO(g) ![]() NO(g) + CO2(g) 反应过程的能量变化如下图所示。
NO(g) + CO2(g) 反应过程的能量变化如下图所示。
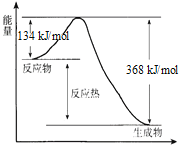
反应过程
(1)该反应是_____________(填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为_____________。
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是_____________。
a.浓度 b.压强 c.温度 d.催化剂
(4)反应体系中加入催化剂对反应热是否有影响?____(填“是”或“否”),原因是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com