
下图是实验室制备四氯化硅的装置示意图。已知:四氯化硅遇水极易反应。

请回答下列问题:
(1)写出装置A中发生反应的化学方程式 ▲ 。
(2)装置A中g管的作用是 ▲ 。
(3)干燥管F中碱石灰的作用是 ▲ 。
(4)该组实验装置中存在的缺陷是 ▲ 。
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
固体粉末X中可能含有Fe、Fe2O3、MnO2、CuO、K2SiO3、K2SO3、NaNO2、KAlO2中的若干种。某同学为确定该固体粉末的成分,取X进行连续实验:
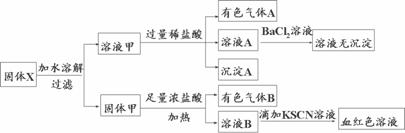
以下说法正确的是
A.溶液甲中一定含有K2SiO3、NaNO2,可能含有KAlO2
B.由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3
C.气体A和气体B一定均为纯净物
D.原混合物中一定含有Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述正确的是

A.金属钠着火时,立即用沾水的毛巾覆盖
B.实验室可用右图所示装置制取饱和氨水
C.硅酸钠溶液保存在带橡胶塞的细口瓶中
D.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在溶液中能大量共存的是
A.K+、Na+、SO42-、CO32- B.NH4+、Na+、SO42-、OH-
C.H+、K+、HCO3-、Cl- D.Al3+、K+、OH-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是
A.氧化还原反应中得失电子总数一定相等 B.化学反应前后原子的总数一定不变
C.电解质溶液中阴阳离子的总数一定相等 D.分解反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
长周期元素周期表共有18个纵行,从左到右排为1~18列,即碱金属是第一列,稀有气体是第18列。按这种规定,下面说法不正确的是 ( )
A.第9列元素中没有非金属
B.第15列元素的原子最外层电子的排布是ns2np3
C.最外层电子排布为ns2的元素都在第2列
D.第10、11列元素分别处在d区和ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氢键的说法正确的是( )
A. 由于氢键的作用,使NH3、H2O、HF的沸点反常, 且沸点高低顺序为HF>H2O>NH3
B. 氢键只能存在于分子间,不能存在于分子内
C. 在固态水(冰)中,水分子间氢键数目增多,造成体积膨胀,密度减小
D. 相同量的水在气态、液态和固态时均有氢键, 且氢键的数目依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
目前大量的照明材料或屏幕都使用了发光二极管(LED)。市售LED晶片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图。试回答:

(1)镓的基态原子的价电子排布式是_______。砷原子的杂化轨道类型是 。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为________,与同一个镓原子相连的砷原子构成的空间构型为________。与砷原子紧邻的等距砷原子数为 。
(3)下列说法正确的是________。
A.砷化镓晶胞结构与NaCl相同 B.电负性:As>Ga
C. GaP与GaAs晶体类型相同,则前者熔点高 D.砷化镓晶体中含有配位键
(4)已知砷化镓的摩尔质量为M g/mol,该晶体的密度是ρ g/pm3 ,则砷原子半径为 ___________pm
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)SO2气体与Fe3+反应的主要产物是_____________、 。(填离子符号)
 (2)下列实验方案可以用于在实验室制取所
(2)下列实验方案可以用于在实验室制取所
需SO2的是 。
A.Na2SO3溶液与HNO3
B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是 。
(4)如果有280mL SO2气体(已折算为标态)
进入C装置中,则C中,50mL NaOH溶液
的浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A 中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,
写出有关离子方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com