
【题目】在某温度时将 ![]() 氨水滴入
氨水滴入 ![]() 盐酸中,溶液 pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
盐酸中,溶液 pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A.![]()
B.水的电离程度:![]()
C.c点:![]()
D.d点:![]()
【答案】D
【解析】
A.如果a=1,当体积为10ml时两者恰好完全反应生成氯化铵,是强酸弱碱盐水解呈酸性,所以a>1,故A错误;
B.b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,NH4+水解促进了水的电离,c点溶液呈中性,则溶质为NH4Cl和NH3H2O,NH3H2O抑制了NH4+的水解,则b点溶液中水的电离程度大于c点溶液中水的电离程度,故B错误;
C.c点溶液呈中性,所以c(H+)=c(OH-),由电荷守恒分析c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以c(NH4+)=c(Cl-)=0.05mol/L,故C错误;
D.d点溶液呈碱性,氨水过量,溶液中为NH4Cl和氨水,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),由于c(H+)<c(OH-),所以c(Cl-)<c(NH4+),故D正确;
故答案为D。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】如图装置,将溶液 A 逐渐加入固体 B 中,下列叙述中不正确的是( )
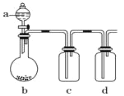
A.若 a 为浓盐酸,b 为 MnO2,c 中盛品红溶液,则 c 中溶液不褪色
B.若 a 为稀硫酸,b 为 FeS,c 中盛硫酸铜溶液,则 c 中产生淡黄色沉淀
C.若 a 为醋酸溶液,b 为贝壳,c 中盛过量澄清石灰水,则 c 中溶液变浑浊
D.若 a 为浓氨水,b 为生石灰,c 中盛 AlCl3 溶液,则 c 中产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在工农业生产中都有重要应用。
(1)氮和肼(N2H4)是两种最常见的氮氢化物。
已知:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化学平衡常数为K1。N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化学平衡常数为K1。N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为__________________,该反应的化学平衡常数K=________(用K1、K2表示)。
N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为__________________,该反应的化学平衡常数K=________(用K1、K2表示)。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在一定温度下,于1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。
①下列能说明该反应已经达到平衡状态的是______(填字母代号)。
A.c(CO)=c(CO2)
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
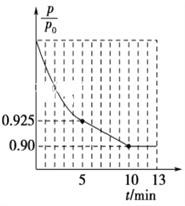
②图1为容器内的压强(p)与起始压强(p0)的比值![]() 随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)=________,平衡时NO的转化率为________。
随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)=________,平衡时NO的转化率为________。
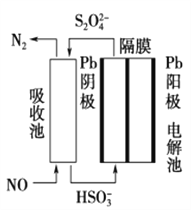
(3)使用间接电化学法可处理燃烧烟气中的NO,装置如图所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:____________________。用离子方程式表示吸收池中除去NO的原理____________________________________________。
【答案】 4NH3(g)+O2(g)2N2H4(g)+2H2O(g)ΔH=+526.2 kJ·mol-1 K1/K22 D 0.006 mol·L-1·min-1 80% 2HSO3-+2e-+2H+===S2O42-+2H2O 2NO+2S2O42-+2H2O===N2+4HSO3-
【解析】(1)①4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。②N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。②N2H4(g)+O2(g) ![]() N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。根据盖斯定律,将①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,该反应的化学平衡常数K=
N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。根据盖斯定律,将①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,该反应的化学平衡常数K=![]() ,故答案为:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol;
,故答案为:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol; ![]() ;
;
(2)对于2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
①A.c(CO)=c(CO2),不表示浓度变化,不能判断是否为平衡状态,故A错误;B.反应中气体的质量不变,体积不变,容器中混合气体的密度始终不变,不能判断是否为平衡状态,故B错误;C.v(N2)正=2v(NO)逆表示,应该是2v(N2)正=v(NO)逆,才表示正逆反应速率相等,故C错误;D.该反应属于气体的物质的量发生变化的反应,容器中混合气体的平均摩尔质量不变时表示气体的物质的量不变, 说明是平衡状态,故D正确;故选D;
②根据容器内的压强(P)与起始压强(P0)的比值(P/P0)随时间(t)的变化曲线,0~5min内,![]() =0.925,根据阿伏伽德罗定律及其推论,
=0.925,根据阿伏伽德罗定律及其推论,![]() =0.925,平衡时
=0.925,平衡时![]() =0.90,
=0.90,
2NO(g)+ 2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(mol) 0.1 0.3 0 0
反应 2x 2x x 2x
5min及平衡 0.1-2x 0.3-2x x 2x
5min时,![]() =0.925,解得x=0.03mol,v(N2)=
=0.925,解得x=0.03mol,v(N2)=![]() = 0.006mol·L-1·min-1;平衡时,
= 0.006mol·L-1·min-1;平衡时,![]() =0.90,解得x=0.04mol,NO的转化率=
=0.90,解得x=0.04mol,NO的转化率=![]() ×100%=80%,故答案为:0.006 mol·L-1·min-1;80%;
×100%=80%,故答案为:0.006 mol·L-1·min-1;80%;
(3)阴极发生还原反应,是亚硫酸氢根离子,得电子,生成硫代硫酸根离子,电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O;硫代硫酸根离子与一氧化氮发生氧化还原反应,生成氮气,离子反应方程式为:2NO+2S2O42-+2H2O═N2+4HSO3-;故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;2NO+2S2O42-+2H2O=N2+4HSO3-。
【题型】填空题
【结束】
10
【题目】锂离子电池是目前具有最高比能量的二次电池。LiFePO4可极大地改善电池体系的安全性能,且具有资源丰富、循环寿命长、环境友好等特点,是锂离子电池正极材料的理想选择。生产LiFePO4的一种工艺流程如图:
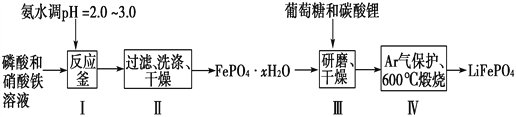
已知:Ksp(FePO4·xH2O)=1.0×10-15,Ksp[Fe(OH)3]=4.0×10-38。
(1)在合成磷酸铁时,步骤Ⅰ中pH的控制是关键。如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是________________。
(2)步骤Ⅱ中,洗涤是为了除去FePO4·xH2O表面附着的________等离子。
(3)取3组FePO4·xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如下表:
实验序号 | 1 | 2 | 3 |
固体失重质量分数 | 19.9% | 20.1% | 20.0% |
固体失重质量分数=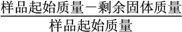 ×100%,则x=_______(精确至0.1)。
×100%,则x=_______(精确至0.1)。
(4)步骤Ⅲ中研磨的作用是__________________________________。
(5)在步骤Ⅳ中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为________。
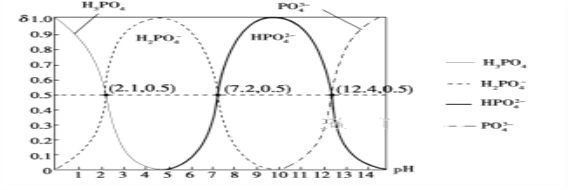
(6)H3PO4是三元酸,如图是常温下溶液中含磷微粒的物质的量分数(δ)随pH变化示意图。则PO![]() 第一步水解的水解常数K1的表达式为______,K1的数值最接近______(填字母)。
第一步水解的水解常数K1的表达式为______,K1的数值最接近______(填字母)。
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列物质的结构简式:
(1)写出与环辛四烯![]() 互为同分异构体且属于芳香烃的分子的结构简式:___。
互为同分异构体且属于芳香烃的分子的结构简式:___。
(2)写出与苯互为同系物且一氯代物只有一种的物质的结构简式(仅写两种支链数不同且支链 数小于4的物质):___、___。
(3)某烷烃A蒸气的密度是相同状况下氢气密度的64倍,经测定得知A分子中共含有6个甲基。
①若A不可能是氢气与烯烃加成的产物,A的结构简式为___;
②若A是炔烃与氢气加成的产物,A的结构简式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
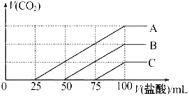
A.原NaOH溶液的浓度为0.2mol/L
B.B烧杯中通入的CO2体积为448mL
C.通入CO2后,不能确定A烧杯中的溶质
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
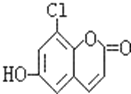
A.2molBr2、2molNaOHB.3molBr2、4molNaOH
C.3molBr2、5molNaOHD.4molBr2、5molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,有pH为a的盐酸和pH为b的NaOH溶液,取VaL该盐酸,同该NaOH溶液中和,需VbLNaOH溶液,填空:
(1)若a+b=14,则Va:Vb=_________(填数字)。
(2)若a+b=13,则Va:Vb=_________(填数字)。
(3)若a+b>14,则Va:Vb=_________(填表达式),且Va__________Vb(填:>、<、=)(题中a≤6、b≥8)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向l0mL0.1mol/L的HR溶液中逐渐滴入0.lmol/L的NH3·H2O 溶液,所得溶液pH及导电性变化如图。下列分析不正确的是

A. ab点导电能力增强,说明HR为弱酸
B. b点溶液,c(NH3H2O)=c(R-)+c(H+)-c(OH-)
C. c点溶液,存在c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 常温下,HR和NH3H2O的电离平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,在“
时,在“![]() ”的水溶液体系中,
”的水溶液体系中,![]() ,
,![]() 和
和![]() 三者中各自所占的物质的量分数
三者中各自所占的物质的量分数![]() 随溶液pH变化的关系如图所示。下列说法正确的是
随溶液pH变化的关系如图所示。下列说法正确的是
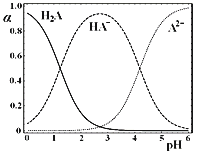
A.在含![]() A、
A、![]() 和
和![]() 的溶液中,加入少量NaOH固体,
的溶液中,加入少量NaOH固体,![]() 一定增大
一定增大
B.将等物质的量的NaHA和![]() 混合物溶于水,所得溶液中
混合物溶于水,所得溶液中![]()
C.NaHA溶液中,![]() 的水解能力大于
的水解能力大于![]() 的电离能力
的电离能力
D.在含![]() A、
A、![]() 和
和![]() 的溶液中,若
的溶液中,若![]() ,则
,则![]() 与
与![]() 不一定相等
不一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com