
如图4-9,硬质玻璃管内,左、中、右分别放有3个湿润棉花球;a球浸有溴化钾溶液;b球浸有碘化钾浓溶液;c球中浸有KI淀粉溶液。实验时,从右端缓缓通入氯气,同时在b处微热,并逐渐向左移动酒精灯,则可以观察到:
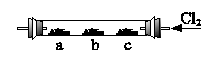
图4-9
(1)在a处有 产生。
(2)在b处有 色产生。
(3)c处变成 色。
(4)稍冷却后,b、c之间的管壁上有 色的 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源:山东省青州一中2012届高三化学一轮跟踪训练:第4章 第4讲 金属材料复合材料(鲁科版) 题型:058
埋藏在地下的青铜器锈蚀过程可以表示为:Cu![]() CuCl
CuCl![]() Cu2O―→X,X由两种物质X1和X2组成,且都由四种元素构成,定性实验表明:X1热分解的产物能使澄清石灰水变浑浊,而X2热分解的产物不能使澄清石灰水变浑浊,但两者均有水珠产生.为了定量测定X1和X2组成,某兴趣小组用如图实验装置对X1和X2分别做热分解实验(夹持装置已省去),实验结束后,硬质玻璃管内均残留黑色固体,分别称重,装置B和C中的质量均增加.
Cu2O―→X,X由两种物质X1和X2组成,且都由四种元素构成,定性实验表明:X1热分解的产物能使澄清石灰水变浑浊,而X2热分解的产物不能使澄清石灰水变浑浊,但两者均有水珠产生.为了定量测定X1和X2组成,某兴趣小组用如图实验装置对X1和X2分别做热分解实验(夹持装置已省去),实验结束后,硬质玻璃管内均残留黑色固体,分别称重,装置B和C中的质量均增加.
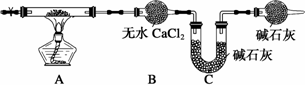
试回答下列问题:
(1)青铜器出土后防止青铜器继续锈蚀的关键是________.
(2)利用上述装置进行热分解实验时,对判断A装置中反应是否完全进行带来困难,为解决此问题,要对B装置进行改装.B应改为内装有________(填试剂名称)的洗气瓶,判断反应完全的现象为________.用经改装的装置,某同学进行正确操作,最终得出的测定结果仍有误差,原因是________(回答一点即可).
(3)在实验装置和实验操作正确的前提下,重做X1的热分解实验,测得装置B和C中质量增重之比Δm(B)∶Δm(C)=9∶11,________(填“能”或“否”)求出X1的化学式,若能求出X1的化学式,则化学式为________(若不能求出X1的化学式,此空不填).
(4)若测得X2中铜元素的质量分数为59.5%(铜元素的相对原子质量为63.5),则X2的化学式为________.X2热分解的化学方程式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
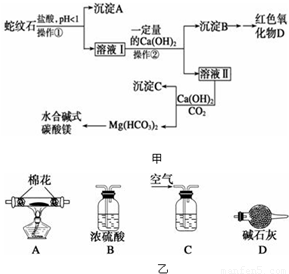
 蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
实验步骤如图甲:
请回答下列问题:
(1)操作①的名称______
(2)检验溶液Ⅱ中是否含有Fe3+的方程式 (最优方法)______
(3)沉淀A与萤石(CaF2)在硫酸酸化下可以制备石膏,写出反应方程式______
(4)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为______
(5)操作②中应控制溶液pH的合理范围是______(填序号).
A.小于1.5B.1.5~3.3 C.7~8 D.大于9.4
(6)为探究所得的水合碱式碳酸镁[xMgCO3?yMg(OH)2?zH2O]的组成,取样18.2g g于装置A的玻璃管中,请按由左-→右顺序将下列装置连接好(如图乙)(填序号,装置可重复使用):______,装置C应盛的试剂是______. 充分反应后,如果实验测得硬质玻璃管中剩余固体8.0g,共放出6.6gCO2气体,则x:y:z=______.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省大庆实验中学高三(上)期中化学试卷(解析版) 题型:解答题
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com