
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
【研究课题】探究草酸晶体受热分解的产物
【查阅资料】该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点/℃ | 密度/g·cm-3 |
草酸 | H2C2O4 | — | 易溶于水 | 189.5 | 1.900 |
草酸晶体 | H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
备注:草酸晶体失去结晶水后,175 ℃以上开始分解。
【提出猜想】(1)__________________________________;
(2)分解产物中的气体可能是CO、CO2或它们的混合物。
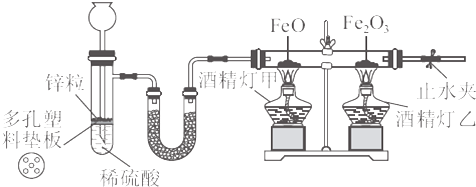
【设计方案】(1)请设计完成“猜想(1)”的实验方案〔用简要的实验装置图表示,要体现所使用仪器(加热和夹持仪器不必画出)和试剂〕。

(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。

①证明分解产物中有CO2的现象是______________________;证明分解产物中有CO的现象是______________________。
②若未连接装置G,要达到同样的目的,可采取的措施是______________________。
【交流讨论】小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【研究课题】 探究草酸晶体受热分解的产物
【查阅资料】 该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点/℃ | 密度/g·cm-3 |
草酸 | H2C2O4 | — | 易溶于水 | 189.5 | 1.900 |
| H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
备注:草酸晶体失去结晶水后,175 ℃以上开始分解。
【提出猜想】(1)_____________________________________________________。
(2)分解产物中的气体可能是CO、CO2或它们的混合物。
【设计方案】 (1)请设计完成“猜想(1)”的实验方案〔用简要的实验装置图表示,要体现所使用仪器(加热和夹持仪器不必画出)和试剂〕。

(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。

①证明分解产物中有CO2的现象是___________________________;证明分解产物中有CO的现象是_________________________________________________________________。
②若未连接装置G,要达到同样的目的,可采取的措施是______________________________
_____________________________________________________________________。
【交流讨论】 小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。
_____________________________________________________________________
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是某化学学习小组的实验记录,请根据实验记录(部分需要补充)回答有关问题。
【研究课题】铜离子颜色的探究
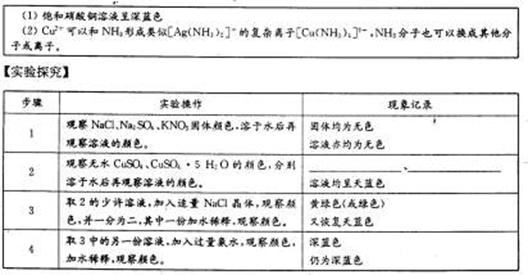 【资料卡片】
【资料卡片】
【交流讨论】
(1)以上所得溶液或物质呈天蓝色的化学粒子符号是 (写化学式,下同);实验步骤4中呈深蓝色的化学粒子符号是 ;使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是 。
(2)请写出实验步骤3中“其中一份加水稀释”的反应离子的方程式: 。
(3)有资料上介绍浓硝酸与铜丝反应后得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因 ,设计两种不同的简单的实验方法证明你的解释:
方案① ;
方案② 。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高二上学期期中考试化学试卷(解析版) 题型:实验题
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是: 。(用所学的知识回答)。
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:(注:褪色原因只有一种)
①溴与乙醛发生取代反应;② ;③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了
如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br—离子的物质的量。
(3)根据方案一,若 ,则猜想②不成立。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br—)= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:①按物质的量之比为1:5配制KBrO3—KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2。②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。若已知CH3COOAg易溶于水。
试通过计算判断:溴与乙醛发生反应的化学方程式为 ;
小张同学认为合适的酸既不是硫酸也不是盐酸,这是为什么? 。
Ⅱ.小钱同学利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。

请填写下列空白:
(1)乙醇发生催化氧化的化学方程式为 。
(2)实验时,小钱同学将甲装置浸在70℃~80℃的水浴中,目的是 _。
小孙同学认为:由于小钱同学装置设计上的缺陷,实验进行时可能会 ____________。
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步探究表明,鼓气速度与反应体系的温度关系曲线如图所示。

请你解释鼓气速度过快,反应体系温度反而下降的原因是: 。
你认为该实验中“鼓气速度”这一变量可用 来计量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com