
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
元素代号 | A | B | C | D | E | F | G |
原子半径/nm | 0.037 | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +2 | +3 | +6、-2 | -1 | -2 | +5、-3 |
(1)C元素在元素周期表中的位置是 ______ ;
(2)B的原子结构示意图为 ______ ;
(3)D、E气态氢化物的稳定性强弱顺序为 ______ (填化学式);
(4)上述七种元素的最高价氧化物对应水化物中酸性最强的是 ______ (填化学式);
(5)以C为材料制成的容器不能贮存强碱溶液,用离子方程式表示其原因为: ______ ;
(6)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号.推测碲元素在周期表中的位置,则碲元素及其化合物可能具有的性质为:______ ;
A.单质碲在常温下是固体B.Cl2通入H2Te溶液中不发生反应
C.H2Te不如HI稳定 D.H2TeO4的酸性比H2SO4的弱
【答案】 第三周期第ШA族 ![]() H2S<HCl HClO4 2Al+2OH-+2H2O=2AlO2-+3H2↑ ACD
H2S<HCl HClO4 2Al+2OH-+2H2O=2AlO2-+3H2↑ ACD
【解析】分析:短周期元素中,D、F都有-2价,处于ⅥA族,D有+6价且原子半径D>F,故D为硫、F为氧;E有-1价,原子半径大于氧,故E为Cl;B、C化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径B>C>硫,故B为Mg、C为Al;A的化合价为+1,处于IA族,原子半径小于氧的,故A为氢;G的化合价为+5、-3,处于VA族,原子半径小于Cl的,则G为N元素,据此解答。
详解:根据以上分析可知A是H、B是Mg、C是Al、D是S、E是Cl、F是O、G是N。则
(1)C为Al元素,在元素周期表中的位置是第三周期第ШA族;
(2)B为Mg元素,原子结构示意图为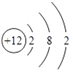 ;
;
(3)由于非金属性S<Cl,非金属性越强,氢化物越稳定,则气态氢化物的稳定性强弱顺序为:H2S<HCl;
(4)非金属性越强,最高价含氧酸的酸性越强,因此上述七种元素的最高价氧化物对应水化物中酸性最强的是HClO4;
(5)以Al为材料制成的容器不能贮存强碱溶液,原因是铝与氢氧化钠溶液反应,方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)A.碲元素在周期表中的位置为第五周期第VIA族,单质碲在常温下是固体,A正确;
B.H2Te与H2S性质类似,Cl2通入H2Te溶液中发生氧化还原反应,B错误;
C.非金属性Te<I,则H2Te不如HI稳定,C正确;
D.非金属性Te<S,则H2TeO4的酸性比H2SO4的弱,D正确。答案选ACD。


科目:高中化学 来源: 题型:
【题目】恒温下,将amolN2与bmH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值__________。
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数为25%。计算平衡时NH3的物质的量为_________________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)=______。
(4)原混合气体中,a:b=______________。
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法不正确的是( ) 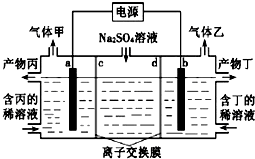
A.a极与电源的正极相连
B.产物丙为硫酸溶液
C.离子交换膜d为阳离子交换膜(允许阳离子通过)
D.a电极反应式为2H2O+2e﹣═2OH﹣+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率可用于衡量电解质溶液导电能力的大小,且电导率越大溶液的导电能力越强。室温下 ,用0.l00 mol·L-1的NH3· H2O 滴定10 .00mL 浓度均为0 . 100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。下列说法正确的是
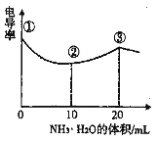
A.① 溶液中c(H +)为0 . 200 mol·L-1
B.溶液温度高低为① >③ >②
C.③ 点后因离子数目减少使电导率略降低
D.③ 点时溶液中有c ( C1一)>(CH3 COO一)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子半径依次增大,且X、Y原子序数之和是W、Z原子序数之和的2 倍,m、n、p、r是由这些元素组成的元化合物,甲、乙是其中两种元素对应的单质,n 与乙均是淡黄色固体。上述物质的转化关系如图所示(部分反应物或生成物省略)。下列说法错误的是

A. 热稳定性: p<r
B. X 与Y组成的化合物一定有漂白性
C. 含Y 元素的盐溶液可能显酸性、中性或碱性
D. Z 与W、X、Y 可形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述中正确的是( )
4NO(g)+6H2O(g),下列叙述中正确的是( )
A. 达到化学平衡时,5v正(O2)=4v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 未达到化学平衡时,正反应速率一定不等于逆反应速率
D. 达到化学平衡时,3v正(NH3)=2v正(H2O)不成立
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题: 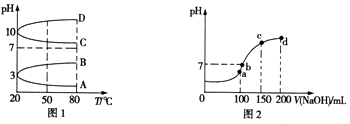
(1)相同条件下,相等浓度的NH4Al(SO4)2溶液中c(NH4+)NH4HSO4溶液中c(NH4+) (填“=”、“>”或“<”).
(2)如图1是0.1molL﹣1电解质溶液的pH随温度变化的图象. ①其中符合0.1molL﹣1 NH4Al(SO4)2的pH随温度变化的曲线是(填写字母).
②室温时,0.1molL﹣1 NH4Al(SO4)2溶液中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=molL﹣1(填
计算式).
(3)室温时,向100mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图2所示.图中a、b、c、d四个点,水的电离程度最大的是;在b点,溶液中各离子浓度由大到小的顺序是 .
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解质溶液为Na2CO3溶液,电解总反应的方程式为 .
(5)一种可超快充电的新型铝电池,充放电时AlCl4﹣和Al2Cl7﹣两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.被誉为改变未来世界的十大新科技之一的燃料电池。 右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.

试回答下列问题:
(1)燃料电池的优点是________;电解质溶液中的OH-移向______极(填“负”或“正”).
(2)写出氢氧燃料电池工作时正极反应式:_______________________。
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________.
(4)利用该装置可以处理氮的氧化物和NH3 尾气,总反应为:6NO2 +8NH3=7N2+12H2O,负极反应式为__________。
II.将锌片和银片浸入稀硫酸中组成原电池,若该电池中两电极的总质量为80 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为41g,试计算:
(1)产生氢气的体积(标准状况)为________________;
(2)通过导线的电子数为__________(用NA表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com