
【题目】游离态氮称为惰性氮,游离态氮转化为化合态氮称之为氮的活化,在氮的循环系统中,氮的过量“活化”,则活化氮开始向大气和水体过量迁移,氮的循环平衡被打破,导致全球环境问题。
Ⅰ. 氮的活化
工业合成氨是氮的活化重要途径之一,在一定条件下,将N2 和 H2 通入到体积为0.5L的恒容容器中,反应过程中各物质的物质的量变化如图所示:

(1)10min内用NH3表示该反应的平均速率,v(NH3)=____________。
(2)在第10min和第25min改变的条件可能分别是_________、________(填字母)。
A.加了催化剂 B. 升高温度 C. 增加NH3的物质的量
D.压缩体积 E.分离出氨气
(3)下列说法能说明该可逆反应达到平衡状态的是__________(填字母)。
A. 容器中气体密度不变 B. 容器中压强不变
C. 3v(H2)正=2v(NH3)逆 D. N2、H2、NH3分子数之比为1∶3∶2
Ⅱ.催化转化为惰性氮 已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
(4)在250C、101KPa时,N2(g)+3H2(g) ![]() 2NH3(g) △H1= -92.4kJ/mol.
2NH3(g) △H1= -92.4kJ/mol.
2H2(g)+O2(g)=2H2O(l) △H2= -571.6 kJ/mol
N2(g)+O2(g)=2NO(g) △H3= +180kJ/mol
则NO与NH3反应生成惰性氮的热化学方程式______________________________。
(5)在有氧条件下,新型催化剂M能催化CO与NOx反应生成N2。现向某密闭容器中充入等物质的量浓度的NO2和CO气体,维持恒温恒容,在催化剂作用下发生反应:
4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H<0,相关数据如下:
N2(g)+4CO2(g) △H<0,相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2) /mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2) /mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①计算此温度下的化学平衡常数K=______,
②实验室模拟电解法吸收NOx装置如图,(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验(a<b),电解时NO2发生反应的电极反应式:_________________________________。

【答案】0.02mol·L-1·min-1 A E B 6NO(g)+4NH3(g)=5 N2(g)+6H2O(l) △H=-2070 kJ·mol-1 1/9(或0.11)(mol·L-1)-1 H2O+NO2-e- = NO3-+2H+
【解析】
(1)10min内氨气的物质的量增加为0.10 mol,根据反应速率![]() =
= ![]() =
= ![]() 计算;
计算;
(2)根据图象知,平衡向正反应方向移动,10 min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;25 min时,瞬间氨气的物质的量减小,据此分析作答;
(3)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(4)NH3脱除NO的化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(l),可结合盖斯定律计算反应热;
(5)①化学平衡常数K等于平衡时生成物浓度幂之积比上反应物浓度幂之积;
②根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子生成硝酸;
(1)根据图象可知,10 min时氨气的物质的量为0.1 mol,则10 min内用NH3表示该反应的平均速率为:v(NH3) = ![]() = 0.02 mol/(Lmin),
= 0.02 mol/(Lmin),
故答案为:0.02 mol/(Lmin);
(2)由图象可知各组分物质的量变化增加,且10min时各物质的变化是连续的,20min达平衡时,△n (N2) = 0.025 mol × 4 = 0.1 mol,△n(H2) = 0.025 mol × 12 = 0.3 mol,△n(NH3) = 0.025 mol × 8 = 0.2 mol,根据物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10 min可能改变的条件是使用催化剂,故A项正确;
B. 升高温度,三种气体物质速率虽会成倍地增大,但根据热效应可知,正反应速率增大的相对慢,故B项错误;
C. 增加NH3物质的量,逆反应速率增加的倍数大,故C项错误;
D. 压缩体积,相当于增大压强,三种气体速率虽会增大,但增大的程度不相同,正反应速率比逆反应速率增大的快,与图像信息不符合,故D项错误;
E. 分离出氨气后,瞬间氨气的物质的量会下降,N2和H2不会改变,与图中10 min描述的状况不符,故E项错误;
故答案为A;
25 min时,瞬间NH3骤降,即NH3的浓度下降,N2和H2在第25 min时刻未变化,平衡向正反应方向移动,则可能的条件为分离出氨气,E项正确;
故答案为:E;
(3)A. 混合气体的质量不变,气体的体积不变,故密度不变,若密度不再随时间变化,不能说明平衡,故A项错误;
B. 容器内前后气体的物质的量有变化,说明压强是变量,总压强不再随时间而变化,说明达到平衡,故B项正确;
C. 3v(H2)正= 2v(NH3)逆,表示的是正反应和逆反应,但是不满足计量数关系,说明没有达到平衡状态,故C项错误;
D. N2、H2、NH3分子数之比为1∶3∶2,无法判断各组分的浓度是否不再变化,故D项错误;
故答案为:B;
(4)在250C、101KPa时,
①N2(g)+3H2(g) ![]() 2NH3(g) △H1= -92.4kJ/mol.
2NH3(g) △H1= -92.4kJ/mol.
②2H2(g)+O2(g)=2H2O(l) △H2= -571.6 kJ/mol
③N2(g)+O2(g)=2NO(g) △H3= +180kJ/mol
利用盖斯定律,将②×3①×2③×3可得6NO(g)+4NH3(g)=5 N2(g)+6H2O(l) △H=-2070 kJ·mol-1,
故答案为:6NO(g)+4NH3(g)=5 N2(g)+6H2O(l) △H=-2070 kJ·mol-1;
(5)①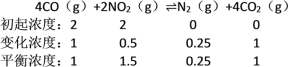
所以K =![]() = 1/9(0.11)(mol·L-1)-1
= 1/9(0.11)(mol·L-1)-1
故答案为:1/9(或0.11)(mol·L-1)-1;
②根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸:H2O+NO2-e- = NO3-+2H+,
故答案为:H2O+NO2-e- = NO3-+2H+;


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】下列两种气体的原子数一定相等的是
A. 质量相等、密度不等的N2和C2H4
B. 等体积、等密度的CO和N2
C. 等温、等体积的O2和Cl2
D. 等压、等体积的NH3和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应N2+3H22NH3 ,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
(1)处于平衡状态的时间段是________(填选项).
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项).
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气
t1时刻________;t3时刻________;t4时刻________.
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是________(填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,此时正向速率________逆向速率(填大于、小于、等于),平衡________移动(填正向、逆向、不移动)。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向H2C2O4溶液中滴加NaOH溶液,若pc=-lg c,则所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)与溶液pH的关系如图所示。下列说法正确的是

A. M点时, 2c(HC2O4-)+c(C2O42-) >c(Na+)
B. pH=x时,c(HC2O4-)<c(H2C2O4)=c(C2O42-)
C. 常温下,Ka2(H2C2O4)=10-1.3
D. ![]() 随pH的升高而减小
随pH的升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1L密闭容器中有0.1molSO2和0.05molO2发生反应,恒温下30min后达到平衡。
(1)若得到0.06molSO3,求达到平衡时SO2的浓度_______。
(2)求30min内的反应速率:v(SO3)、v(O2)_______。
(3)求平衡时气体压强与开始时气体压强之比_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1mol/L的氢氧化钠溶液与0.06mol/L硫酸溶液等体积混合,溶液的pH等于
A. 1.7 B. 2.0 C. 10 D. 12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作:①过滤;②取固体试剂;③蒸发;④取液体试剂;⑤溶解。一定要 用到玻璃棒的是( )。
A. ①③⑤ B. ②③④ C. ①③④ D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com