
【题目】下列物质的分类正确的是
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | HCl | NaOH | SO2 | CO2 |
B | NaOH | H2SO4 | NaCl | Na2O | CO2 |
C | KOH | HNO3 | CaCO3 | CaO | CO |
D | NaOH | HCl | CaF2 | Na2O2 | SO2 |
A.AB.BC.CD.D
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是
A. 周期表里主族元素所在的族序数等于原子核外电子数
B. 周期表里元素所在的周期序数等于原子核外电子层数
C. 元素周期表有7个主族,7个副族,1个0族,1个第Ⅷ族,共16纵行
D. X2+的核外电子数目为18,则X在第四周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图a、b、c、d均为铂电极,供选择的电解质溶液如下表( )
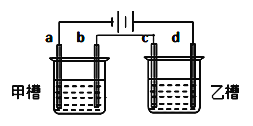
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;
②b、c两极放电离子的物质的量相等。则应选用的电解液是
组 | A | B | C | D |
甲槽 | NaOH | Cu(NO3)2 | KCl | Na2SO4 |
乙槽 | CuSO4 | NaCl | AgNO3 | NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数.下列说法正确的是( )
A.标准状况下,22.4 L 苯中含有的苯分子数是NA
B.标准状况下,1mol氦气中含有的核外电子数为4NA
C.常温常压下,15g乙烷分子中含有的碳氢键数目为3 NA
D.常温常压下,0.10 molL﹣1CH3COOH溶液中含有的H+数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,也是一种植物生长调节剂,在生产生活中有重要应用。下列有关乙烯及其工业产品乙醇的性质及应用,请作答。
(1)将乙烯气体通入溴的四氯化碳溶液中,反应的化学方程式为_______________________;
(2)下列各组化学反应中,反应原理相同的是___________(填序号);
①乙烯使溴的四氯化碳溶液褪色和乙烯使酸性KMnO4溶液褪色
②苯与液溴在催化剂作用下的反应和乙醇使酸性KMnO4溶液褪色
③甲烷光照条件下与氯气反应和苯与硝酸在浓硫酸条件下反应
(3)取等物质的量的乙醇和乙烯,在足量的氧气中完全燃烧,两者耗氧量的关系乙醇___________乙烯(填大于、小于、等于);
(4)工业上可由乙烯水合法生产乙醇,乙烯水合法可分为两步(H2SO4可以看作HOSO3H)
第一步:反应CH2=CH2+HOSO3H(浓硫酸)→CH3CH2OSO3H(硫酸氢乙酯);
第二步:硫酸氢乙酯水解生成乙醇。
①第一步属于___________(填反应类型)反应;
②上述整个过程中浓硫酸的作用是___________(填选项)
A.氧化剂 B.催化剂 C.还原剂
(5)发酵法制乙醇,植物秸秆(含50%纤维素)为原料经以下转化制得乙醇
植物秸秆![]() C6H12O6
C6H12O6![]() 2CH3CH2OH+2CO2↑
2CH3CH2OH+2CO2↑
现要制取2.3吨乙醇,至少需要植物秸秆___________吨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用容量瓶准确配制一定浓度的NaCl溶液时,下列操作会使溶液浓度偏低的是( )
A.用粗盐代替NaCl固体
B.定容时,溶液液面低于容量瓶刻度线
C.从烧杯向容量瓶转移溶液时,有少量溶液溅出
D.向容量瓶转移溶液时,容量瓶中有少量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g)p C(g)△H,在密闭容器中进行,如图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )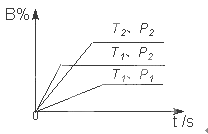
A.T1<T2 , P1>P2 , m+n>p,△H<0
B.T1>T2 , P1<P2 , m+n>p,△H>0
C.T1<T2 , P1>P2 , m+n<p,△H<0
D.T1>T2 , P1<P2 , m+n<p,△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水可以提取溴和镁,提取过程如下:
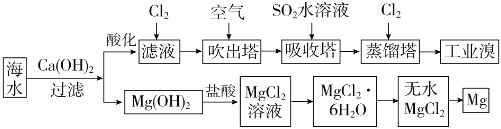
(1)提取溴的过程中,经过2次![]() 转化的目的是__________,吸收塔中发生反应的离子方程式是
转化的目的是__________,吸收塔中发生反应的离子方程式是![]() ,蒸馏塔中发生反应的离子方程式是____________。
,蒸馏塔中发生反应的离子方程式是____________。
(2)从![]() 溶液中得到
溶液中得到![]() 晶体的主要操作是__________、_________、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是__________。
晶体的主要操作是__________、_________、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是__________。
(3)据上述流程,将![]() 海水中溴元素(海水中
海水中溴元素(海水中![]() 离子含量为
离子含量为![]() )转化为工业溴,整个流程中至少需要标准状况下
)转化为工业溴,整个流程中至少需要标准状况下![]() 的体积为_________L(忽略
的体积为_________L(忽略![]() 溶解)。
溶解)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com