
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体。旧|法合成的反应是:
①(CH3)2C=O+HCN→(CH3)2C(OH)CN
②(CH3)2C(OH)CN+CH3OH+H2SO4→CH2=C(CH3)COOCH3+NH4HSO4
新法合成的反应是:③CH3C≡CH+CO+CH3OH![]() CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
下列说法不正确的是
A. 反应②中CH3OH是CH2OHCH2OH(乙二醇)的同系物
B. 反应③符合绿色化学思想
C. 甲基丙烯酸甲酯有两种官能团
D. 反应①是加成反应
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中不正确的是( )
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3﹣O﹣CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.过量铁片与100mL 0.01mol/L的稀盐酸反应,能量变化趋势,如图所示:

(1)该反应为__________反应(填“吸热”或“放热”)。
(2)为了加快产生H2的速率而不改变H2的产量,可以使用如下方法中的______
①加H2O ②加入几滴1mol/LHNO3溶液 ③滴入几滴浓盐酸
④加入一定量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液
⑦适当升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
A. ②③⑥⑦⑧ B. ③④7⑧ C. ③⑥⑦⑧ D. ③⑥⑦
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜电极上发生的电极反应为________。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:

(1)分析有关数据,写出X、Y、Z的反应方程式__________。
(2)该反应在3种不同条件下进行,其中Y起始浓度相同,Z起始浓度为0,反应物X的浓度随反应时间的变化情况如下表:

①实验1中,在10~20min内,以物质Y表示的平均反应速率为________mol/(L·min) ,50min时,实验3中Z的浓度________。
②0~20min内,其它条件一样实验2和实验1的反应速率不同,其原因可能是__________;实验3和实验1的反应速率不同,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铜易溶于水,在130℃时会发生分解反应是一种燃烧催化剂,以食盐等为原料制备高氯酸铜[Cu(ClC4)2·6H2O)]的一种工艺凯程如下:
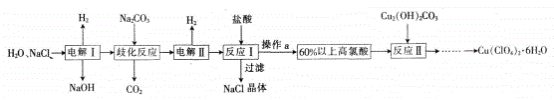
回答下列问题:
(1)发生“电解I”时所用的交换膜是______(填“阳离子交换膜”或“阴离子交换膜”)。
(2)改化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。
①“歧化反应”的化学方程式为_____________。
②“歧化反应”阶段所采用的不同温度对产率影响的结果如图所示。则该反应最适宜的温度是________。

(3)“电解Ⅱ”的阳极产物为________ (填离子符号)。
(4)操作a的名称是______,该流程中可循环利用的物质是________(填化学式)。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a t。最终制得的Cu(ClO4)2·6H2O为bt,则产率为_______(用含a、b的代数式表示)。
(6)某温度下,高氯酸铜控制在A、B的种方式同时分解,分解过程中铜的化合价不发生改变。A方式为Cu(ClO4)2![]() CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式为________(用化学方程式表示)。
CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式为________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,m、n、p、q、s是由这些元素中的两种或三种元素组成的化合物,r是由元素C形成的单质,上述物质的转化关系如图所示。常温下0.01 mol·L-1s溶液的pH为12。下列说法正确的是

A. 原子半径的大小B<C<D
B. 化合物n与s中均既含有离子键,又含有共价键
C. 1L0.1mol·L-1的q溶液中阴离子总数等于0.1NA
D. 1mol n与足量的p完全反应可生成11.2L的r
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用乙醇与浓硫酸来制取乙烯,反应装置如下图A所示,发生反应为CH3CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O

请回答下列问题:
Ⅰ.制取实验中,混合乙醇与浓硫酸的操作是_________,通常在圆底烧瓶中加入几粒碎瓷片的作用是_________________,装置A图中一处明显的错误是____________________。
Ⅱ.用该方法在实验室制取乙烯时,常会看到烧瓶中液体变黑,并使装置A中制得的乙烯中混有CO2、SO2等杂质气体。为确定乙烯及各种杂质气体的存在,请用上面给出的实验装置完成下面的实验探究设计。
探究设计1:若要检验A中所得气体含有SO2,可将混合气体直接通入__________(填装置代号,下同)装置;若要检验A中所得气体含有乙烯,可将混合气体直接通入____________________。
探究设计2:若将A中所得气体依次通过①→②→③→E装置,根据实验现象可确定乙烯气体中混有二氧化硫气体。
则:(1)设计2中①→②→③装置对应的装置分别是___________________(填装置代号)。
(2)设计2中能说明二氧化硫气体存在的现象是___________________________。
(3)使用装置②的目的是____________________。使用装置③的目的是________________________。
(4)设计2中确认乙烯气体存在的现象是_____________________。
探究设计3:若要一次性将乙烯、CO2、SO2三种气体全部检验出来,气体被检验出来的先后顺序是___________________,气体通过装置的顺序为A→______(填装置代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃、101 kPa下,0.5 mol辛烷C8H8燃烧生成二氧化碳和液态水时放出2 759 kJ热量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
D.2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) ΔH=+11 036 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com