
分析 (1)利用盖斯定律,(Ⅰ)×2+(Ⅱ)×2+(Ⅲ)可得甲烷与氧气制取甲醇的方程式,据此计算反应热即可;
(2)测得SO2的平衡转化率为50%,可知反应的SO2物质的量为1mol,此过程中放出热量98.3kJ,可知2molSO2参加反应放出的热量,以此计算a值;
计算出平衡时各物质的浓度,可计算平衡常数;
若将初始温度为T1℃的2mol SO2和1molO2充入容积为2L的绝热密闭容器B中,因正反应放热,则体系温度升高,升高温度平衡逆向移动;
(3)可循环利用的为NaOH,可用亚硫酸钠与氢氧化钙反应生成;
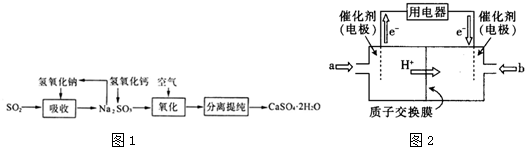
(4)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应;
②根据电解池的工作原理和电极方程式来计算.
解答 解:(1)根据(Ⅰ)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
(Ⅱ)CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ•mol-1
(Ⅲ)2CO(g)+O2(g)?2CO2(g)△H3=-566.0kJ•mol-1
由(Ⅰ)×2+(Ⅱ)×2+(Ⅲ)得2CH4(g)+O2(g)?2CH3OH(g)△H,故△H=2△H1+2△H2+△H3=(+247.3kJ•mol-1)×2+(-90.1kJ•mol-1)×2+(-566.0kJ•mol-1)=-251.6kJ•mol-1,所以用CH4和O2直接制备甲醇蒸气的热化学方程式为2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ•mol-1,
故答案为:2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ•mol-1;
(2)测得SO2的平衡转化率为50%,可知反应的SO2物质的量为1mol,此过程中放出热量98.3kJ,可知2molSO2参加反应放出的热量为196.6,则a=-196.6,平衡时:c(SO2)=0.5mol/L,c(O2)=0.5mol/L,c(SO3)=0.25mol/L,K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}=\frac{0.{5}^{2}}{0.{5}^{2}×0.25}$=4,若将初始温度为T1℃的2mol SO2和1molO2充入容积为2L的绝热密闭容器B中,因正反应放热,则体系温度升高,升高温度平衡逆向移动,则平衡常数减小,故答案为:-196.6;4;>;
(3)可循环利用的为NaOH,可用亚硫酸钠与氢氧化钙反应生成,反应的方程式为Na2SO3+Ca(OH)2=CaSO3↓+2NaOH,故答案为:Na2SO3+Ca(OH)2=CaSO3↓+2NaOH;
(4)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,故答案为:负极;CH3OH-6e-+H2O=CO2+6H+;
②用此电池以惰性电极电解饱和食盐水的电极反应为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,当两极共收集到标准状况下的气体1.12L(0.05mol)时,则生成氢氧化钠的物质的量是0.05mol,所以COH-=$\frac{0.05mol}{0.5L}$=0.1mol/L,所以pH=13,故答案为:13.
点评 本题考查较为综合,涉及物质的性质,分离以及化学平衡的计算等问题,为高考常见题型,侧重于学生的分析、计算和实验能力的考查,注意把握平衡常数的计算以及平衡移动的影响,难度中等.


科目:高中化学 来源: 题型:解答题
 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小,请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 转化 | 解释 | |
| A | CuS+H2SO4=CuSO4+H2S↑ | 酸性:H2SO4>H2S |
| B | AgCl(s)+I-(aq)?AgI(s)+Cl-(aq) | Kap(AgCl)<Kap(AgI) |
| C | 2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;Fe+S$\frac{\underline{\;加热\;}}{\;}$FeS | 氧化性:Cl2>S |
| D | C(s,石墨)=C(s,金刚石)△H=+1.9kL/mol | 稳定性:石墨<金刚石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用厨房垃圾发酵制沼气属于物理变化 | |
| B. | 可用水作镁铝合金爆炸时的灭火剂 | |
| C. | 推广使用煤液化技术科减少温室气体二氧化碳的排放 | |
| D. | 超导材料K3C60在熔融状态下能够导电,说明K3C60是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 变质的油脂有难闻的特殊气味,是由于油脂与水发生了水解反应 | |
| B. | 家用消毒液发生器其原理是用石墨作电极电解饱和氯化钠溶液,制得有较强杀菌能力的消毒液 | |
| C. | 过氧乙酸可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可以使病毒和细菌体内的蛋白质变性 | |
| D. | 家庭中不宜用铝合金容器长期存放菜、汤等食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定需将标准溶液直接注入到用水清洗后的滴定管中 | |
| B. | 若需94 mL1.00mol/LNaCl溶液,需称5.85g NaCl配制成100mL溶液 | |
| C. | 用一元酸和一元碱测定中和反应热时,取等体积等浓度的稀溶液为佳 | |
| D. | 测定稀酸或稀碱溶液的pH时,需将待测液直接滴在湿润的pH试纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 平衡浓度/(mol•L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Y遇到氯化铁溶液时显紫色,X能使溴的四氯化碳溶液褪色 | |
| B. | X含3个手性碳原子 | |
| C. | 1mol X与足量NaOH溶液反应,最多可消耗3mol NaOH | |
| D. | 1个Y分子中最多有8个原子共面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com