
| A. | K3C60中既有离子键,又有极性键 | |
| B. | 该物质在熔融状态下能导电 | |
| C. | 该物质的化学式写成KC20 | |
| D. | 1mol K3C60中含有的离子键的数目为3NA个 |
分析 A、一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
B、含有自由移动离子或电子的物质能导电;
C、化学式表示该物质的组成;
D、1mol K3C60中含有3mol钾离子、1mol阴离子;
解答 解:解:A.K3C60是离子化合物,阴阳离子之间存在离子键,C原子之间存在共价键,同种元素形成的共价键是非极性键,故A错误;
B、该物质是离子化合物,为电解质,在熔融状态下能电离出阴阳离子而导电,故B正确;
C、化学式表示该物质的组成,其化学式为K3C60,不能写为KC20,故C错误;
D、1mol K3C60中含有3mol钾离子、1mol阴离子,所以1mol K3C60中含有的离子数目为4NA个,故D错误;
故选B.
点评 本题以信息给予为载体考查了离子化合物,明确该物质的构成微粒结合物质导电的原因来分析看到,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
 .
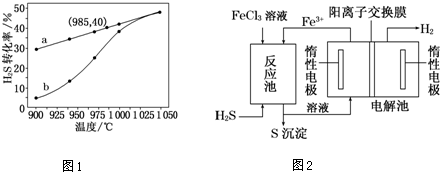
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散系的分类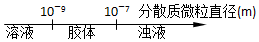 | |
| B. | Fe与Cl2反应的产物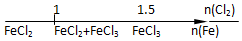 | |
| C. | 向AlCl3溶液滴加NaOH溶液后铝的存在形式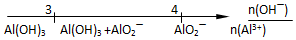 | |
| D. | Na与O2反应的产物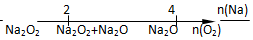 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液A和B均可以是盐酸或NaOH溶液 | |
| B. | 若溶液B选用浓H2SO4,反应条件需要加热,剩余固体为铝 | |
| C. | 溶液A和B均不可选用稀HNO3 | |
| D. | 实验室中方案Ⅱ更容易实施 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 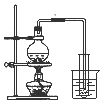 制取少量蒸馏水 | B. |  制取少量NO2 | ||
| C. | 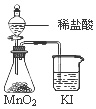 比较MnO2、Cl2、I2的氧化性 | D. |  量取8.50mL的 稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2参加反应转移电子数一定为4NA | |
| B. | 一定条件下,足量铜与2 mol的浓硫酸充分反应,转移电子数为2NA | |
| C. | 300mL2mol/L乙醇溶液中所含乙醇分子数为0.6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. ,反应类型是酯化反应(或取代反应).
,反应类型是酯化反应(或取代反应). .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com