
【题目】短周期元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊
B.戊不可能为金属
C.氢氧化物碱性:丙>丁>戊
D.氢化物的稳定性:甲>乙
科目:高中化学 来源: 题型:
【题目】将相同质量的两份金属铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积比为
A. 1∶1 B. 1∶3 C. 2∶3 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计氨催化氧化实验,并将制得NO进一步氧化为NO2用水吸收NO2 , 并检验HNO3的生成.
可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、CaO
可供选择的液体药品有:浓氨水、过氧化氢、浓盐酸、水
可供选择的仪器有:如图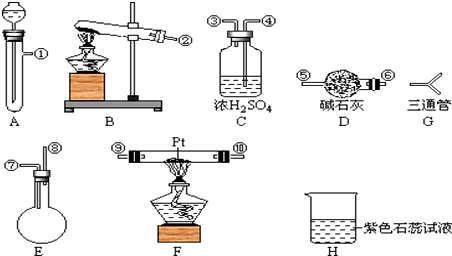
另有铁架台、铁夹、铁圈、乳胶管若干,可供选择.设计实验时,A和B两个制气装置允许使用两次,其余装置只能使用一次.
(1)氨氧化制NO的化学方程式为 , 该反应应在装置中进行.
(2)为快速制O2和NH3 , 制取O2化学方程式为;制取NH3化学反应方程式为
(3)利用快速制NH3和O2的装置组装,各仪器按气流方向连接的正确顺序为(按装置先后顺序排列)![]()
(4)装置C的作用是 .
(5)装置H中溶液变红,其原因是(用化学方程式表示) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空 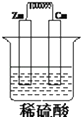
(1)锌为:极(填“正”或“负”)电极反应式为: ,
(2)反应过程中电流的方向为:
A 由铜流向锌 B 由锌流向铜
(3)若有锌片质量减少了0.65g,则转移了mol电子发生转移,铜片上产生气体的体积(标况下)为:L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃0.5 mol能与1 molHCl完全加成,加成后的产物分子上的氢原子又可被2 molCl2完全取代。则此气态烃可能是( )
A. HC≡CH B. CH2=CH2
C. HC≡C-CH3 D. CH2=C(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
(1)已知反应CH3—CH3(g) → CH2=CH2(g)+H2(g),有关化学键键能如下。
化学键 | C—H | C=C | C—C | H—H |
键能/kJ·mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热___________________________
(2)已知H2(g)+Br2(l)=2HBr(g);ΔH=-72 kJ/mol。蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其它相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | a | 369 |
则表中a为__________
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。试依据下列热化学方程式,计算反应
2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变ΔH=________。
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
(4)如下图Ⅰ所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________________________________________________________________。
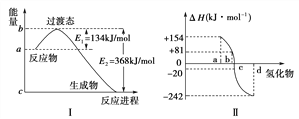
(5)图Ⅱ表示氧族元素中的氧、硫、硒(Se)、碲(Te)在生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢发生分解反应的热化学方程式:_____________________。
(6)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g);ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH=+19 kJ·mol-1
请写出CO还原FeO的热化学方程式:__________________________。
(7) 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。热化学方程式为:N2H4(l) + 2H2O2(l) == N2(g) + 4 H2O(g) △ H=-644.25 kJ/molspan>。又已知H2O (l) == H2O (g) ΔH=+ 44 kJ/mol。则64g液态肼
与液态双氧水反应生成液态水时放出的热量是 _________________ kJ。
(8)焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用右图所示电解装置吸收和转化SO2 (A,B均为惰性电极)。下列说法正确的是

A. B电极为电解池的阴极
B. B极区吸收5mo1 SO2,则A极区生成2.5 mo1 S2O42-
C. B极区电解液为稀硫酸,电解一段时间后硫酸浓度增大
D. A电极的电极反应为:2SO32--2e-+4H+=S2O42- + 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com