
��ҵ�ƴ���ĵ�һ����ͨ������ʳ��ˮ�����Ͷ�����̼֮��ķ�Ӧ����ȡ̼�����ƾ��塣�÷�Ӧԭ�����������»�ѧ����ʽ��ʾ���˷�Ӧ�Ƿ��ȷ�Ӧ��
�������� NH3 + CO2 + H2O + NaCl�����ͣ���![]() �� NaHCO3�����壩��+ NH4Cl
�� NaHCO3�����壩��+ NH4Cl
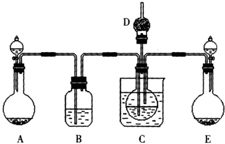
��1��ijУѧ��ʵ��С������������Ӧԭ���������ͼ��ʾװ�ã���ȡ̼�����ƾ��塣C�ձ���ʢ�б�ˮ��D��װ��պϡ�������֬�ޣ�ͼ�мг�װ������ȥ��
��ѡ�õ�ҩƷ�У�a��ʯ��ʯ b����ʯ�� c��6 mol/L���� d��ϡ���ᡡ e��Ũ��ˮ
f�������Ȼ�����Һ��

����A���Ʊ�����ʱ������ҩƷ�ǣ�ѡ����ĸ���ţ��������������� ��
��B��ʢ�б���̼��������Һ�������������������������������� ��
����ʵ������У���C��ͨ�����������Ⱥ�˳��ģ�Ӧ��ͨ������Ļ�ѧʽΪ������ ��
�ܼ���D���ڴ��Ƿ��а����ݳ��ķ����������������������������������������� ��
��2����С��ͬѧΪ�˲ⶨC�����þ����̼�����ƵĴ��ȣ����辧���в���̼�������ʣ����������ָ����������Ϊwg���ٽ�������ȵ��������ٱ仯ʱ���������÷�ĩ����Ϊmg��Ȼ�������ͼ��ʾʵ�飺

���ڲ���II�У�Ϊ���жϼ����Ȼ�����Һ�Ƿ����,������ȷ����(ѡ����ĸ���)���� ��
A���ڼ����Ȼ�����Һ�������ã�����Һ�м������������Ȼ�����Һ
B���ڼ����Ȼ�����Һ�������ã�����Һ���ټ�������̼������Һ
C���ڼ����Ȼ�����Һ�������ã�ȡ�ϲ���Һ�ټ�������̼������Һ
�ڲ���III�ķ���Ϊ���������������� ���������������� ���������������� ��
�����þ�����̼�����ƵĴ���Ϊ���������������������������������������� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2010?����ģ�⣩��ҵ�ƴ���ĵ�һ����ͨ������ʳ��ˮ�����Ͷ�����̼֮��ķ�Ӧ����ȡ̼�����ƾ��壮�÷�Ӧԭ�����������»�ѧ����ʽ��ʾ���˷�Ӧ�Ƿ��ȷ�Ӧ��NH3+CO2+H2O+NaCl �����ͣ��TNaHCO3�����壩+NH4Cl
��2010?����ģ�⣩��ҵ�ƴ���ĵ�һ����ͨ������ʳ��ˮ�����Ͷ�����̼֮��ķ�Ӧ����ȡ̼�����ƾ��壮�÷�Ӧԭ�����������»�ѧ����ʽ��ʾ���˷�Ӧ�Ƿ��ȷ�Ӧ��NH3+CO2+H2O+NaCl �����ͣ��TNaHCO3�����壩+NH4Cl
| 42n |
| 25w |
| 42n |
| 25w |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| NaCl | NaHCO3 | NH4Cl | |
| 10�� | 35.8 | 8.15 | 33.0 |
| 45�� | 37.0 | 14.0 | 50.0 |
| b�Ma��ȡֵ��Χ | ���� | �������ʵ��� | ||||
0��b�Ma��5�M4 0��b�Ma��5�M4 |
NH3 NH3 |
��a-4b�M5��mol ��a-4b�M5��mol | ||||
|
-- | -- | ||||
5�M4��b�Ma��2 5�M4��b�Ma��2 |
HNO3 HNO3 |
��4b-5a���M3mol ��4b-5a���M3mol | ||||
b�Ma��2 b�Ma��2 |
HNO3 HNO3 |
amol amol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ģ�� ���ͣ��ʴ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ϻ����ֶ�����������ѧ����ģ���Ի�ѧ�Ծ��������棩 ���ͣ�������
�����ǻ�ѧ��ҵ��Ӧ�÷dz��㷺�����ʡ���������������������Ҫ��;��
�������Ƽ���ķ���Ϊ�����й�������ҵ��������Ҫ���ס��Ƽ�ĵ�һ����Ӧ���Ͱ�����ˮ��ͨ�������̼���÷�Ӧ�ɱ�ʾΪ��NaCl + CO2 + NH3 + H2O �� NaHCO3��+ NH4Cl
����45��ʱ��ȡ117gʳ�����Ƴɱ�����Һ��������ͨ��������������������ͨ�������̼��ʹ��Ӧ������ȫ���Լ��㲢�ش��������⣨������ȡ��λ��Ч���֣����й����ʵ��ܽ�������������λ��g/100gˮ����
|
|
NaCl |
NaHCO3 |
NH4Cl |
|
10�� |
35.8 |
8.15 |
33.0 |
|
45�� |
37.0 |
14.0 |
50.0 |
��1��117gʳ�������Ͽ�����ȡ���� g��
��2��45�淴Ӧ��Ϻ��о�����������Һ��ʣ��ˮ g��������������� g��
��3�����˳�ȥ�����ľ�����ٽ�����10�棬���о������������������������������ ��
��ҵ������Ҳ�ǰ�����Ҫ��;֮һ����Ӧ���£�
4NH3+5O2��4NO+6H2O 2NO+O2��2NO2 3NO2+H2O��2HNO3+NO
��a mol��NH3��b mol��O2��Ϻ���һ�ܱ���������Pt������������700�棬��ַ�Ӧ����ȴ�����¡�
 ��4��������b�Ma��ȡֵ��Χ����֮��Ӧ����Һ�����ʼ������ʵ���������������±��У�
��4��������b�Ma��ȡֵ��Χ����֮��Ӧ����Һ�����ʼ������ʵ���������������±��У�
|
b�Ma��ȡֵ��Χ |
���� |
�������ʵ��� |
|
|
|
|
|
|
���� |
���� |
|
|
|
|
|
|
|
|
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com