
某同学设计如下图所示装置,探究氯碱工业原理,下列说法正确的是
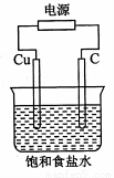
A.石墨电极与直流电源负极相连
B.用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色
C.氢氧化钠在石墨电极附近产生, Na+向石墨电极迁移
D.铜电极的反应式为:2H+ + 2e-= H2↑
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届四川省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)氮和硫的化合物对大气都有严重污染,据所学化学反应原理回答下列问题:
(1)NO2与悬浮在大气中海盐粒子的相互作用时发生反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) ∆H = a KJ/mol
NaNO3(s)+ClNO(g) ∆H = a KJ/mol
则该反应为 反应(填放热或吸热),产物ClNO的结构式为 。
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数K a=1.7×10-5mol/L,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)若将SO2,NO2,O2按4:4:3通入水中充分反应,写出总的离子方程式 。
(4)向氨水中通入过量的H2S,所得溶液M中溶质的电子式为 ;取0.2mol/L的NaOH溶液与0.1mol/L的M溶液等体积混合,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是 ,此时测得溶液的pH=12,则此条件下M溶液中阴离子的电离平衡常数Ka= (提示:若涉及多元弱酸的电离或多元弱酸根离子的水解,均只考虑第一步电离或水解)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省太原市高一上入学考试化学试卷(解析版) 题型:选择题
除去下列物质中的少量杂质,所用方法正确的是( )
选项 | 物质(括号内为杂质) | 除去杂质的方法 |
A | KCl(MnO2) | 加水溶解,过滤,洗涤,干燥 |
B | FeSO4溶液(CuSO4) | 加入适量的锌粉,过滤 |
C | NaCl溶液(CuCl2) | 加入过量的NaOH溶液,过滤 |
D | O2(H2O) | 将混合气体通过盛有足量浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省合肥市高二上开学考试化学试卷(解析版) 题型:选择题
下列各组顺序的排列错误的是
A.半径:F—>Na+>Mg2+>Al3+ B.沸点:H2O< H2S < H2Se
C.酸性:HClO4>H2SO4>H3PO4 D.熔点:SiO2>NaCl>CO2
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三第一次月考理综化学试卷(解析版) 题型:实验题
(13分)用98%的浓H2SO4(ρ=1.84g/cm3)配制250ml 0.5mol/L的稀H2SO4的操作简单可概括为计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶。请按要求填空:
(1)所需浓H2SO4的体积为 。
(2)如果实验室有10mL、20mL、50mL量筒,应选用 mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将 (偏高、偏低、无影响)。·
(3)除量筒和胶头滴管外还需用到的玻璃仪器有: 。
(4)洗涤操作一般要求重复 次,且洗涤液均要 。
(5)定容的操作为:向容量瓶中加入蒸馏水,至液面离刻度线 处,改用胶头滴管滴加,至 。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
某不纯的铁片可能含有Mg、Al、Cu等金属杂质的一种或几种,取该铁片样品5.6g与足量的稀硫酸反应,得到标准状况下的H2 2.24L,则下列分析的结论中,正确的是
A.一定同时含有三种金属杂质
B.一定不含有杂质铜
C.一定含有杂质镁
D.可能同时含有杂质镁.铝或其中一种
查看答案和解析>>
科目:高中化学 来源:2016届广西桂林市高三第一次月考化学试卷(解析版) 题型:选择题
有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只
能表示一个化学反应的是
① Fe+Cu2+===Fe2++Cu ② Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
③ Cl2+H2O===H++Cl-+HClO ④ CO32-+2H+===CO2↑+H2O
⑤ Ag++Cl-===AgCl↓
A、只有③ B、②③ C、③⑤ D、①④
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省平凉市高三上学期第一次模拟考试化学试卷(解析版) 题型:填空题
(18分)氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如示意图所示,完成下列填空:
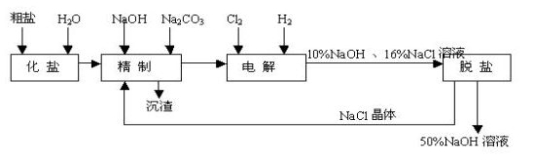
(1)在电解过程中,与电源负极相连的电极上的电极反应式为________________,若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为___________________
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是_____ (选填a、b、c)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为________(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发浓缩、冷却、________(填写操作名称)除去NaCl。
(6)在电解过程中,发生总反应的化学方程式为__________________
(7)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应,请写出Cl2和NaOH溶液反应的化学方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com