
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%)。某同学设计了如下方案,分离样品中各种金属元素。请回答下列问题。
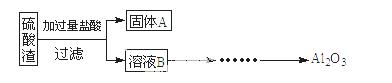
(1)写出溶液B的溶质是 。
(2)参照以下框图形式进一步完 成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作) 。
成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作) 。
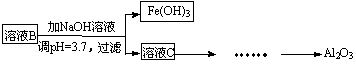
(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。写出反应的离方程式: 。
科目:高中化学 来源: 题型:
【化学—选修5:有机化学基础】A是一取代芳香化合物,相对分子质量为136,分子中只含碳、氢、氧,其中氧的含量为23.5%。实验表明: A的芳环侧链上只含一个官能团;A和NaOH溶液反应后酸化可以得到E(C7H6O2)和F。
(1)A、E、F的结构简式。
(2)A和NaOH溶液反应、酸化的实验装置如下:
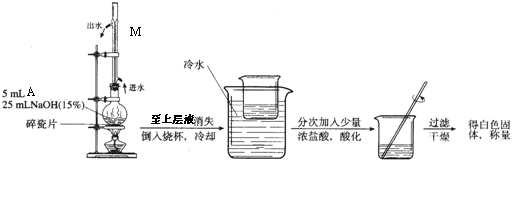

 写出A与NaOH溶液反应的化学反应方程式 。
写出A与NaOH溶液反应的化学反应方程式 。
写出实验装置中M的名称和作用 。
(3)A有多种同分异构体,符合下列条件的结构共有 种,
①可以发生银镜反应 ②属于芳香族化合物,不具备其它环状结构
③可以与氢氧化钠溶液反应 ④不能与FeCl3发生显色反应
请写出其中核磁共振氢谱有5个吸收峰的A的结构的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:
丙烯酸乙酯(化合物Ⅳ)是制备塑料、树脂等高聚物的重要中间体,可由下面路线合成:
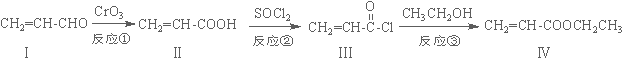 (1)化合物Ⅳ的分子式为 ,1 mol化合物Ⅳ完全燃烧消耗O2为 mol。
(1)化合物Ⅳ的分子式为 ,1 mol化合物Ⅳ完全燃烧消耗O2为 mol。
(2)化合物Ⅱ能使溴水褪色,其反应方程式为 。
(3)反应②属于 反应,化合物Ⅰ可以由化合物Ⅴ(分子式为C3H6O)催化氧化得到,则化合物Ⅴ→Ⅰ的反应方程式为 。
(4)化合物Ⅵ是化合物Ⅳ的同分异构体,Ⅵ含有碳碳双键并能与NaHCO3溶液反应放出气体,其核磁共振氢谱峰面积之比为1:1:6,则化合物Ⅵ的结构简式为 。
(5)一定条件下,化合物  也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 。
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学—选修3:物质结构与性质】(15分)
向盛有硫酸铜水溶液的试管里加入氮水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
I.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1)写出与H2O分子互为等电子体的微粒:_________(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+ )。下列对上述过程的描述不合理的是_________________(填字母序号)。
A.氧原子的杂化类型发生了改变 B.微粒子的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
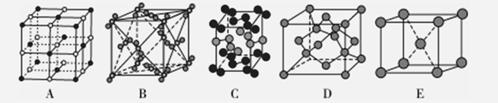
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序)。与冰的晶体体类型相同的是________________(请用相应的编号填写)。
II.胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。
(4)写出铜原子价电子层的电子排布式______________,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有____________________(填元素符号)。
(5)实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有_______________.
(6)实验过程中加入C2H5OH后可观察到析出深蓝色[Cu(NH3)4]SO4·H2O晶体。实验中所加C2H5OH的作用是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
减少酸雨产生的途径可采取下列中的哪些措施:①少用煤作燃料 ②把工厂烟囱 造高 ③燃料脱硫 ④飞机、汽车等交通工具采用清洁燃料,如天然气、甲醇等⑤开发新能源( )
造高 ③燃料脱硫 ④飞机、汽车等交通工具采用清洁燃料,如天然气、甲醇等⑤开发新能源( )
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
有 X和
X和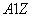 X+两种粒子,下列叙述正确的是 ( )
X+两种粒子,下列叙述正确的是 ( )
A.一定都是由质子、中子、电子组成的
B.化学性质几乎完全相同
C.质子数一定相等,质量数和中子数一定不相等
D.核电荷数和核外电子数一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,下列说法错误的是( )
| 电离能/kJ·mol-1 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11 |
A.元素X的常见化合价是+1价
 B.元素Y是第ⅢA族元素
B.元素Y是第ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,则它可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
Fenton法常用于处理含难降解有机物的工业废水,通常 是在调节好pH和
是在调节好pH和
Fe2+浓度的 废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-
废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-
CP,探究有关因素对该降解反应速率的影响.
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下 表),设计如
表),设计如
下对比实验.
(1)请完成以下实验设计表(表中不要留空格).
| 实验 编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ | 298 | 10 | 6.0 | 0.30 |
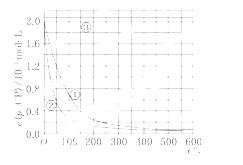
[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图.
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:v(p-CP)=________mol/(L·s).
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________________.
(4)实验③得出的结论是:pH等于10时,________.
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:_______________________
_______________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素周期表的说法不正确的是 ( )
A.除0族元素外,非金属元素全部都是主族元素
B.第3周期非金属元素含氧酸的酸性从左到右依次增强
C.同周期第ⅡA族与第ⅢA族元素的原子序数之差可能为25
D.同族上下相邻两种元素的原子序数之差可能为32
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com