铁和铜是生活中常见的金属.
(I)高铁酸钾(K
2FeO
4)是一种新型的高效氧化剂和消毒剂,用于饮用水处理.其工业制备用次氯酸钠、氢氧化钠溶液将硝酸铁氧化为高铁酸钠,然后用氢氧化钾转化为高铁酸钾.过滤得粗品,并用氢氧化钾溶液溶解,重结晶,用苯和95%乙醇进行脱碱、乙醚洗涤,干燥,制得高铁酸钾.请回答下列问题:
(1)写出工业制备次氯酸钠的离子反应方程式
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
.
(2)高铁酸钠与氢氧化钾反应转化为高铁酸钾,该反应能够发生的原因是
高铁酸钾的溶解度比高铁酸钠溶解度要小
高铁酸钾的溶解度比高铁酸钠溶解度要小
.将高铁酸钾加入水中有红褐色沉淀产生,该过程中也会使溶液的pH明显升高,同时有气泡冒出.其变化的化学方程式是
4K2FeO4+10H2O=4Fe(OH)3↓+8KOH+3O2↑.
4K2FeO4+10H2O=4Fe(OH)3↓+8KOH+3O2↑.
.
(Ⅱ)铜与浓硫酸反应因条件不同生成的产物不同.某同学做铜与浓硫酸反应的实验时,观察到如下现象:
①开始加热一会后先产生气泡,有细小黑色颗粒状物质从铜片表面进入浓硫酸中,形成黑色悬浊液.
②随着温度升高,铜片表面黑色颗粒消失,试管中产生了细小的白色颗粒状物质.
③继续加热至沸腾,其过程中也有气泡产生.停止加热静置,试管底部沉积的固体物质有黑色的和白色的,经检验黑色物质为硫化铜.
④将试管内的溶液倒入另一支试管中,溶液的蓝色不够明显.
请回答问题:
(1)请写出现象①的化学反应方程式
;
(2)写出③反应的化学方程式
5Cu+6H
2SO
4(浓)4CuSO
4+CuS↓+6H
2O+SO
2↑
5Cu+6H
2SO
4(浓)4CuSO
4+CuS↓+6H
2O+SO
2↑
.
(3)解释④现象产生的原因是
反应过程中生成的少量水以水蒸气随SO2释放出去,
因此生成的CuSO4几乎没有水溶解,反应后试管中的液体几乎都是浓H2SO4而不是CuSO4溶液
反应过程中生成的少量水以水蒸气随SO2释放出去,
因此生成的CuSO4几乎没有水溶解,反应后试管中的液体几乎都是浓H2SO4而不是CuSO4溶液
.
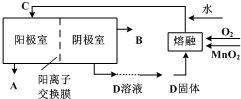
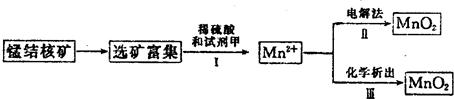
(Ⅲ)高锰酸钾是深紫色的针状晶体,是常用的氧化剂之一.
实验室可用软锰矿(主要成分是MnO
2 )为原料制备高锰酸钾,基本过程如下:
(1)将软锰矿与KOH的混合物放入铁坩埚内,混合均匀,小火加热,并用铁棒搅拌,使混合物熔融,即可得绿色的K
2MnO
4.反应的化学方程式为2MnO
2+4KOH+O
2═2K
2MnO
4+2H
2O实验中,不能将铁棒改为玻璃棒,理由是
高温下KOH会腐蚀玻璃并带进硅酸盐等杂质.
高温下KOH会腐蚀玻璃并带进硅酸盐等杂质.
;
(2)将K
2MnO
4溶于水,通入CO
2气体发生反应可制得KMnO
4,同时产生了黑色沉淀.该反应的化学方程式为
3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
.

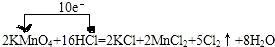
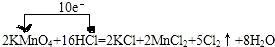
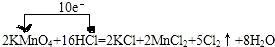 ,
,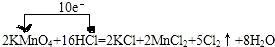 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案