
| A.反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H> 0 |
| B.工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极 |
| C.常温下,0.1mol·L-1 CH3COOH溶液pH=1 |
| D.常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小 |
科目:高中化学 来源:不详 题型:单选题
| A.都不能形成原电池 | B.负极材料依次为镁片、铝片 |
| C.负极材料依次为铝片、镁片 | D.负极材料都是镁片 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。 NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。
NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向醋酸钠溶液中加水稀释时,溶液中所有离子浓度都减小 |
| B.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
| C.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H<0,则该反应一定能自发进行 |
D.对N2(g)+3H2(g) 2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.任何化学反应不一定都有反应热 |
| B.使用催化剂可以改变反应的平衡常数 |
| C.升高温度使反应加快,是因为降低了反应的活化能 |
| D.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
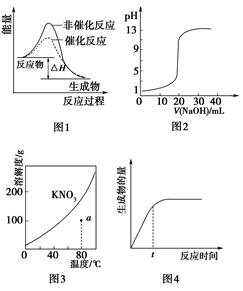
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80 ℃时KNO3的不饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时刻反应物转化率最大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应CaCO3(s)=CaO(s)+CO2(g)在常温下不能发生,则该反应的△H>0 |
B.0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中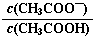 的值减小 的值减小 |
| C.铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 0(填“>’或“<”)。
0(填“>’或“<”)。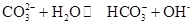 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知常温常压下4Fe(s)+3O2(g)=2Fe2O3(s)是自发反应, 则该反应是吸热反应 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
C.一定条件下2molPCl3和2molCl2发生反应PCl3(g)+Cl2(g)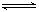 PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75% PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75% |
| D.用pH分别为2和3的醋酸中和等量的NaOH,消耗醋酸的体积分别为V1和V2,则V1>10V2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com