
| A. | 原子核外电子层数越多,原子半径越大 | |
| B. | 每一主族所含非金属元素的种类可表示为︳族序数-2? | |
| C. | 根据泡利原理将氧元素基态原子的电子排布图书写为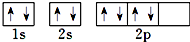 | |
| D. | C2H2分子中的碳采取sp2杂化 |
分析 A、原子半径的影响因素除核外电子层数外,还有核电荷数;
B、根据元素周期表可知:每一主族所含非金属元素的种类可表示为︳族序数-2︳;
C、根据洪特规则:原子核外电子在能量相同的各个轨道上排布时①电子尽可能分占不同的原子轨道,②自旋状态相同,③全空、全满或半满时能量最低;
保里不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子.
D、根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂质类型;
解答 解:A、原子半径的影响因素除核外电子层数外,还有核电荷数,核电荷数越多,对核外电子的吸引力越大,半径越小,如锂原子半径>铝原子半径,故A错误;
B、每一主族所含非金属元素的种类可表示为︳族序数-2︳,故B正确;
C、根据泡利原理同时考虑洪特规,则氧元素基态原子的电子排布图书写为 ,故C错误;
,故C错误;
D、C2H2的结构式为H-C≡C-H,分子中每个碳原子杂化轨道数为2,所以采取sp杂化,故D错误.
故选B.
点评 本题主要考查了原子半径大小比较、元素周期表、电子排布图以及原子杂化类型的判断,注意每一主族所含非金属元素的种类可表示为︳族序数-2︳,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷中的乙烯(酸性高锰酸钾溶液,洗气) | |
| B. | 溴苯中的溴(水,分液) | |
| C. | 乙烯中的SO2(溴水,洗气) | |
| D. | 乙醇中的水(CaO,蒸馏) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯滴入溴水中,振荡后水层接近无色 | |
| B. | 乙烯使酸性KMnO4溶液褪色 | |
| C. | 甲烷与氯气混合,光照后黄绿色变浅 | |
| D. | 乙烯使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100体积的水和100体积的酒精混合,所得混合溶液的体积等于200体积 | |
| B. | 串联电路中电流大小处处相等 | |
| C. | 稀盐酸和氢氧化钠溶液混合后,所得溶液质量与反应前溶液的总质量相等 | |
| D. | 在化学反应中,反应物的原子种类和总数等于生成物的原子种类和总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在密闭容器中,反应X2(g)+Y2(g)?2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是( )
在密闭容器中,反应X2(g)+Y2(g)?2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是( )| A. | 可能是减小了反应物的浓度,反应物X2转化率一定减小 | |
| B. | 可能是加入了催化剂,反应物X2百分含量(X2%)将增大 | |
| C. | 可能是缩小了容器的体积,但该反应的平衡常数保持不变 | |
| D. | 可能是升高了温度,该反应的平衡常数一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1和图3 | B. | 图2和图3 | C. | 图1 和图4 | D. | 只有 图1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(C1-)+c(ClO- )+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(OH+)>c( H2CO3) | |
| C. | pH=ll的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.2 mol•L-l CH3COOH溶液与0.1 mol•L-l NaOH溶液等体积混合:2c(H+)-2c(OH-)=C(CH3COO-)-c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com