
【题目】美国药物学家最近合成一种可能用于治疗高血压的有机物K,合成路线如下:
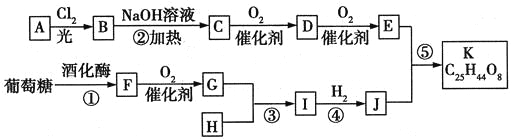
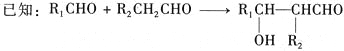
其中A属于碳氢化合物,其中碳的质量分数约为83.3%;E的核磁共振氢谱中只有2组吸收峰。H常温下呈气态,是室内装潢产生的主要污染物之一。G和H以1:3反应生成I。
试回答下列问题:
(1)A的分子式为:______________。
(2)写出下列物质的结构简式:D:____________;G:___________。
(3)反应①―⑤中属于取代反应的有___________。
(4)反应①的化学方程式为_______________;反应④的化学方程式为_________________。
(5)E有多种同分异构体,符合“既能发生银镜反应又能发生水解反应”条件的E的同分异构体有_______种,写出符合上述条件且核磁共振氢谱只有2组吸收峰的E的同分异构体的结构简式:________。
【答案】C5H12 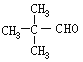 CH3CHO ②⑤ C6H12O6
CH3CHO ②⑤ C6H12O6![]() 2C2H5OH + 2CO2↑
2C2H5OH + 2CO2↑  4 HCOOC(CH3)3
4 HCOOC(CH3)3
【解析】
A属于碳氢化合物,其中碳的质量分数约为83.3%,因此A中![]() =
=![]() =
=![]() ,则A为C5H12;H常温下呈气态,是室内装潢产生的主要污染物之一,H为HCHO,根据流程图,B为卤代烃,C为醇,D为醛,E为酸;F为乙醇,G为乙醛,G和H以1:3反应生成I,根据信息,I为
,则A为C5H12;H常温下呈气态,是室内装潢产生的主要污染物之一,H为HCHO,根据流程图,B为卤代烃,C为醇,D为醛,E为酸;F为乙醇,G为乙醛,G和H以1:3反应生成I,根据信息,I为 ,J为
,J为 ,E和J以4:1发生酯化反应生成K,E为一元羧酸,E的核磁共振氢谱中只有2组吸收峰,E为
,E和J以4:1发生酯化反应生成K,E为一元羧酸,E的核磁共振氢谱中只有2组吸收峰,E为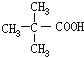 ,则D为
,则D为 ,C为
,C为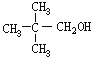 。
。
(1)根据上述分析可知,A的分子式为C5H12,故答案为:C5H12;
(2)根据上述分析,D的结构简式为 ;G为乙醛,结构简式为CH3CHO,故答案为:
;G为乙醛,结构简式为CH3CHO,故答案为: ;CH3CHO;
;CH3CHO;
(3)根据流程图可知,反应①是葡萄糖的分解反应;反应②为卤代烃的水解反应,属于取代反应;反应③是醛和醛的加成反应;反应④是醛的氢化反应,属于加成反应;反应⑤是酯化反应,属于取代反应,②⑤属于取代反应,故答案为:②⑤;
(4)反应①是葡萄糖在酒化酶的作用下生成乙醇和二氧化碳,反应的化学方程式为C6H12O6![]() 2C2H5OH + 2CO2↑;反应④是在催化剂作用下,
2C2H5OH + 2CO2↑;反应④是在催化剂作用下, 与氢气共热发生加成反应,反应的化学方程式为
与氢气共热发生加成反应,反应的化学方程式为 ,故答案为:C6H12O6
,故答案为:C6H12O6![]() 2C2H5OH + 2CO2↑;
2C2H5OH + 2CO2↑;;
(5)既能发生银镜反应又能发生水解反应,表明分子结构中含有醛基和酯基,E为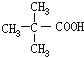 ,E的同分异构体属于甲酸酯,同分异构体的结构为HCOOC4H9,因为丁基有4种结构,故E的同分异构体有4种,其中核磁共振氢谱只有2组吸收峰的E的同分异构体的结构简式为HCOOC(CH3)3,故答案为:4;HCOOC(CH3)3。
,E的同分异构体属于甲酸酯,同分异构体的结构为HCOOC4H9,因为丁基有4种结构,故E的同分异构体有4种,其中核磁共振氢谱只有2组吸收峰的E的同分异构体的结构简式为HCOOC(CH3)3,故答案为:4;HCOOC(CH3)3。


科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理,实验时关闭图1中的a,用单孔塞(插有吸入水的胶头滴管)塞紧颈口c,将水挤入三颈烧瓶中,打开b,完成喷泉实验。电脑绘制三颈烧瓶内压强变化曲线图2。下列说法正确的是
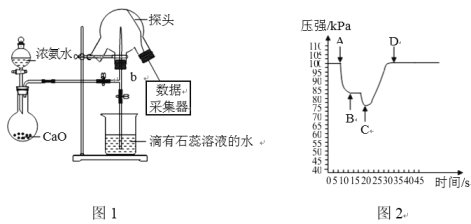
A.干燥氨气通常可选用浓硫酸B.三颈烧瓶内可以看到红色喷泉
C.由图2可知C点时喷泉最剧烈D.图1中氧化钙可用氯化钙代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池的工作原理:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料MnxZn(1-x)Fe2O4,其工艺流程如图所示:
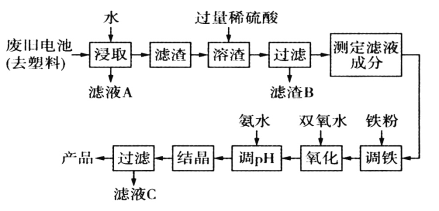
(1)滤液A中溶质的电子式为____________。
(2)已知MnxZn(1-x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中锰元素的化合价相同,则铁元素的化合价为_________。
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:_____________________________。
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1-X)Fe2O4相符合。
①写出“调铁"工序中发生反应的离子方程式:_________________,___________________。
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=amol.L-1,c(Fe2+)+c(Fe3+)=bmol.L-1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为________kg(忽略溶液体积变化,用含a、b的代数式表示)。
(5)在“氧化"工序中,加入双氧水的目的是把Fe2+氧化为Fe3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是_______________。
(6)用氨水“调pH"后,经“结晶”“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中的离子浓度由小到大的顺序为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气有毒,且大量制取的难度较大、污染严重,在培养皿中研究氯气的性质可实现“绿色实验”。在培养皿的点滴板中央孔穴中滴加能生成氯气的试剂(如漂粉精与盐酸),然后分别滴加所要进行实验的试剂,如下图。下列是某学生观察到的现象、解释与结论,其中不符合事实的是( )
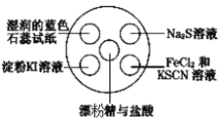
选项 | 实验现象 | 解释 | 结论 |
A | 淀粉 | 氯气置换出 | 氧化性: |
B |
| 氯气置换出 | 非金属性: |
C | 湿润的蓝色石蕊试纸先变红后褪色 | 氯气与水反应生成盐酸和次氯酸 | 氯气具有漂白性 |
D |
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯(图 a)是一种由单层碳原子构成的平面结构新型导电材料,具有大п共轭体系。石墨烯 中部分碳原子被氧化后,其平面结构发生改变,转化为氧化石墨烯(图b)。
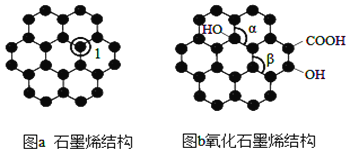
(1)图a中,1号C的杂化方式为______,石墨烯中含有的化学键类型是_____(填极性键,非极性键);图b中键角α____键角β(填“ >”、“<”或“=”),水分子的空间构型是____。
(2)基态钒原子的价电子排布式为______。
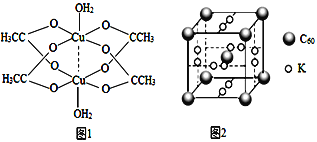
(3)醋酸铜可合成复合材料石墨烯![]() ,其制备原料为CuSO4、NH3·H2O和醋酸等。
,其制备原料为CuSO4、NH3·H2O和醋酸等。
①写出一种与SO42-互为等电子体的分子______。
②二聚醋酸铜的结构示意图如图1所示,Cu2+的配位数为______。
(4)石墨烯可转化为富勒烯(C60),C60和K能形成新型化合物,其晶胞如图2所示,晶胞边长参数为anm,该化合物中K原子和C60分子的个数比为_____,该晶体的密度ρ=_____ g.cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述不正确的是
A. 常温常压下,1 mol氦气中含有的质子数为2NA
B. l0g46%乙醇水溶液中所含氧原子数为0.4NA
C. 1 Ll mol/LNa2CO3溶液中,阴离子总数小于NA
D. 浓硝酸热分解生成NO2、N2O4共23g,转移电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系如图,则下列说法正确的是( )
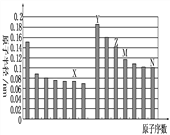
A . Z、N两种元素形成的化合物熔融状态下可以导电
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中
D.由X与M两种元素组成的化合物能与水反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com