
化学在人类生活中扮演着重要角色,下列说法正确的是( )
A.使用无磷洗衣粉,可彻底解决水体富营养化问题
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.油脂皂化生成的高级脂肪酸钠是肥皂的有效成分
D.天然药物无任何毒副作用,可长期服用
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某碳酸钾和碳酸氢钾组成的混合物样品61.4 g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸
的体积,得到如图所示的曲线。下列说法不正确的是

A.该过程所发生反应的化学方程式:
K2CO3+HCl = KCl+ KHCO3;
KHCO3+HCl = KCl +H2O+CO2↑
B.混合物中碳元素的质量分数为8.5%
C.混合物样品中含碳酸钾41.4g
D.若将61.4 g原混合物样品充分加热,放出CO2的质量为4.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S: Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是
A.CuS<Cu(OH)2<CuCO3 B.CuCO3<Cu(OH)2<CuS
C.CuS<CuCO3<Cu(OH)2 D.Cu(OH)2<CuCO3<CuS
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述中,合理的是
A.用pH试纸测得氯水的pH为2
B.电解氯化镁溶液在阴极析出金属镁。
C.向Na2CO3与NaOH的混合溶液中只需加入酚酞试液,即可确认NaOH的存在
D.实验室配制氯化亚铁溶液时,可先将氯化亚铁溶解在盐酸中,再加入蒸馏水稀释,最后加入少量铁屑
查看答案和解析>>
科目:高中化学 来源: 题型:
有关阿佛加德罗常数(NA),下列说法中正确的是( )
A.1 mol SiO2晶体中,含有2NA个Si-O共价键
B.常温下,4.4 g CO2和N2O混合物中所含有的原子数为0.3 NA
C.0.2 mol Cl2溶解于等体积的水中,转移电子数为0.2NA
D.标准状况下,11.2 L 四氯化碳所含分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
将pH=3的盐酸与pH=11的氨水等体积混合后,离子浓度大小关系正确的是( )
A.c(NH4+)>c(Cl—)>c(H+)>c(OH—)
B.c(NH4+)>c(Cl—)>c(OH-)>c(H+)
C.c(Cl—)>c(NH4+)>c(H+)>c(OH—)
D.c(NH4+)+ c(H+)>c(Cl—)+ c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
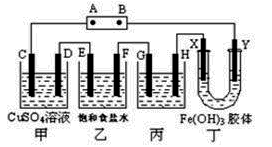 |
(1)电源B 极的名称是___________。
(2)甲装置中电解反应的总化学方程式是:______ _____。
(3)设电解质溶液过量,则同一时内C、D电极上参加反应的单质或生成的单质的物质的量之比是__________。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质)精炼,G极材料应该是__________(填“粗铜”或“精铜” ),电解液中原电解质的物质的量浓度将__________(填“变大”、“变小”或“不变” )。
(5)装置丁中的现象是________________________________________。
(6)设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
700℃时,向容积为1 L的密闭容器中充入一定量的CO2和H2,发生反应:
CO2+H2(g)  CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min | n(CO2)/mol | H2/ mol |
| 0 | 1.50 | 1.00 |
| t1 | 0.40 | |
| t2 | 0.90 |
下列说法不正确的是
A.反应在t1 min内的平均速率为v(H2O)=0.60 /t1 mol·L-1·min-1
B.温度升至800℃,上述反应平衡常数为1.56,则正反应为放热反应
C.保持其他条件不变,向平衡体系中再通入1.00 molH2,与原平衡相比,达到新平衡时CO2转化率增大,H2的体积分数增大
D.保持其他条件不变,起始时向容器中充入1.00 molCO和1.50 molH2O,到达平衡时,c(CO2)=0.90 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com