
【题目】硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下。该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法正确的是
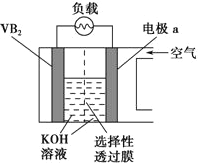
A. 电极a为电池负极
B. 反应过程中溶液的pH升高
C. 电池连续反应过程中,选择性透过膜采用阳离子选择性膜
D. VB2极的电极反应式为:2VB2+ 22OH-22e=V2O5+ 2B2O3+ 11H2O
【答案】D
【解析】分析:硼化钒-空气燃料电池中,VB2在负极失电子,电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O,氧气在正极上得电子,生成OH-,OH-通过选择性透过膜向负极移动,电池总反应为:4VB2+11O2=4B2O3+2V2O5,由此分析解答。
详解:A、硼化钒-空气燃料电池中,VB2在负极失电子,氧气在正极上得电子,所以a为正极,A错误;
B、硼化钒-空气燃料电池中,VB2在负极失电子,氧气在正极上得电子,电池总反应为:4VB2+11O2=4B2O3+2V2O5,所以反应过程中溶液的pH不变,B错误;
C、氧气在正极上得电子生成OH-,OH-通过选择性透过膜向负极移动,所以图中选择性透过膜应只允许阴离子通过,C错误;
D、负极上是VB2失电子发生氧化反应,则VB2极发生的电极反应为2VB2+22OH--22e-=V2O5+2B2O3+11H2O,D正确。答案选D。


科目:高中化学 来源: 题型:
【题目】实验室可利用硫酸厂废渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式可表示为[Fe2(OH)n(SO4)3-0.5n]m,主要工艺流程下:
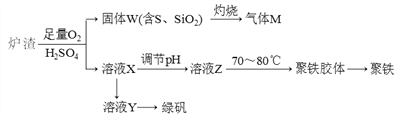
下列说法不正确的是
A. 炉渣中FeS与稀硫酸和氧气反应的离子方程式为:4FeS+3O2+12H+===4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入H2O2溶液得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸干即得绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2) 制取MnSO4·H2O并回收单质硫的工艺流程如下:
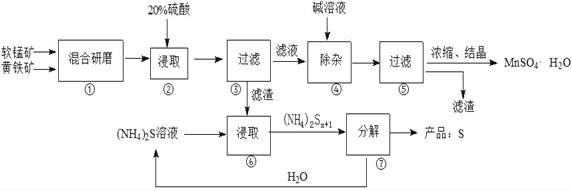
已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是_____________________________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_____________________________________。
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入______________________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4~5,再继续煮沸一段时间,“继续煮沸”的目的是_____________________________________。步骤⑤所得滤渣为__________________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为_________________________________。
(4)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液VmL,产品中Mn2+的质量分数为w(Mn2+)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解精炼铜的阳极泥中主要含Ag、Au等贵重金属。以下是从精炼铜的阳极泥中回收银、金的流程图:
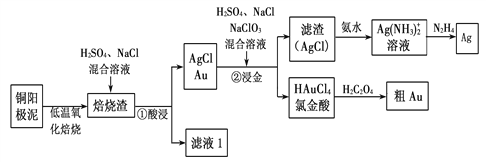
(1)氯金酸(HAuCl4)中的Au的化合价为________。
(2)“焙烧渣”在“①酸浸”时发生反应的离子方程式为_________。
(3)铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是________。
(4)已知N2H4被银氨溶液氧化的产物是氮气,则每生成1molAg,需要消耗_______g N2H4。
(5)氯金酸(HAuCl4)在pH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为____________。
(6)阳极泥中的铜可以用FeC13溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合右图分析(其中的纵坐标代表金属阳离子浓度的对数):
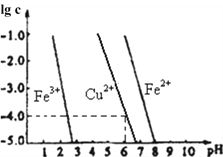
①要从浸出液中提纯铜,最好先加入酸化的双氧水,目的是___________________________________,然后加入适量的CuO调节pH=3.7,除去________离子;
②从图中数据计算可得Cu(OH)2的Ksp约为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种物质均含有同一种元素,它们之间存在如图所示的转化关系:
![]()
(1)若A、B、C均属于盐类且为厨房中的常见物质,则B为_________,列举其在生活中的一种用途________。
(2)若A、C均属于盐类,且A常用作净水剂,B为白色胶状不溶物,A与过量氨水反应的离子方程式为_____________________________________。
(3)若A为一种无色气体单质,X为一种黑色固体单质,则C为_________,B与Na2O2反应方程式____________________________。
(4)若A为一种金属单质,X为一种无色气体单质,C为淡黄色粉末,将A投入CuSO4溶液中的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A. 金属钠与水反应:Na +2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
B. 用氢氧化钡溶液中和硫酸溶液:Ba2++OH-+H++SO42-![]() H2O+BaSO4↓
H2O+BaSO4↓
C. 氯化铝溶液中加入过量的氨水:Al3++ 4NH3·H2O ![]() AlO2- + 4NH4++ 2H2O
AlO2- + 4NH4++ 2H2O
D. 在澄清石灰水中通入过量的CO2:OH-+CO2![]() HCO3-
HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅酸蓄电池是常见的化学电源,其电极材料分别是Pb和PbO2,电解质溶液为一定浓度的硫酸。充放电的总反应是: Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O

(1)该蓄电池放电工作时电解质溶液中SO42-移向________(填“正极”或“负极”,下同)充电时,该极接直流电源的_________。
(2)Cu2O是一种半导体材料,可通过右图的电解装置制取,电解总反应为:2Cu+H2O![]() Cu2O+H2↑
Cu2O+H2↑
阴极的电极反应式是__________________________。 若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时,Cu2O的理论产量为_______g。
(3)为防止钢闸门在水中被腐蚀,可将其与铅酸蓄电池的_______极相连(填Pb或PbO2)。
(4)用铅蓄电池电解500mL饱和食盐水(足量)。电解一段时间后,共收集到气体1120mL(已折算成标准状况下),则所得溶液的pH=_________(不考虑气体的溶解及电解前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
①增加水的量或温度,都可以加快镁跟水的反应速率。
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率。
③对反应3H2(g) + N2(g) ![]() 2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
④对于反应3KSCN(aq) + FeCl3(aq)![]() Fe(SCN)3(aq)+ 3KC l(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
Fe(SCN)3(aq)+ 3KC l(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
A. ①② B. ①④ C. ②④ D. 无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辣椒素是辣椒的活性成分,可在口腔中产生灼烧感,能够起到降血压和胆固醇的功效,进而在很大程
度上预防心脏病,也能缀解肌肉关节疼痛。辣椒素酯类化合物的结构可以表示为:
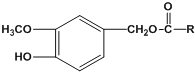
其中一种辣椒素脂类化合物J的合成路线如下:
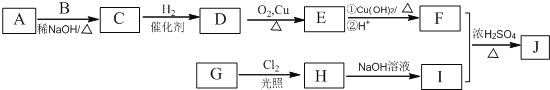
已知:①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰
②J的分子式为C15H22O4
③![]()
回答下列问题:
(1)G所含官能团的名称为_______________________。
(2)由A和B生成C的化学方程式为___________________。
(3)由C生成D的反应类型为____________,D的化学名称为________________。
(4)由H生成I的化学方程式为_______________________。
(5)在G的同分异构体中,苯环上的一氯代物只有种的共有_____种(不含立体异构),其中核磁共振氢谱显示两组峰的是__________(写结构简式)。
(6)参照上述路线,设计一条以乙醛为原料(无机试剂任选)合成乙酸正丁酯的路线:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com