
某温度下的CuSO4溶液200克,蒸发掉31克水,恢复到原温度,或向其中加入25克CuSO45H2O晶体,均可使溶液达到饱和。该温度下CuSO4的溶解度为 ( )
A.40g B.32 g C.29g D.80g
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:阅读理解
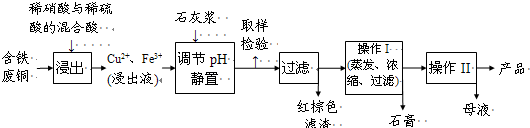
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
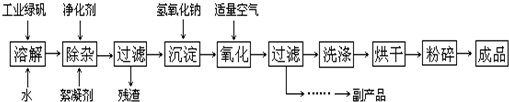
查看答案和解析>>
科目:高中化学 来源: 题型:
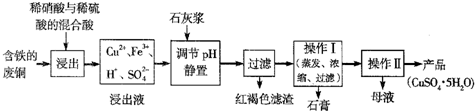
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
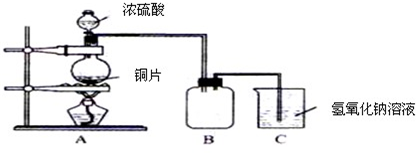
| ||
| ||
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.在该温度下,100 g水溶解的CuSO4·5H2O的质量
B.将该温度下的CuSO4饱和溶液蒸发掉100 g水再恢复到原来的温度,析出晶体的质量
C.该温度下,100 gCuSO4饱和溶液中,含有的CuSO4的质量
D.该温度下,CuSO4的饱和溶液中水的质量减少100 g,溶液中减少的CuSO4质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com