
| I/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 738 | 1451 | 7733 | 10540 |
| Y | 496 | 4562 | 6912 | 9540 |
| Z | 577 | 1817 | 2745 | 11578 |
分析 根据同周期元素的电离能判断元素的种类,X的I3电离能突然增大,说明最外层有2个电子,应为Mg,Y的I2电离能突然增大,说明最外层有1个电子,应为Na,Z的I4电离能突然增大,说明最外层有3个电子,应为Al,结合同周期元素从左到右元素的电负性逐渐增强解答.
解答 解:同周期元素的电离能判断元素的种类,X的I3电离能突然增大,说明最外层有2个电子,应为Mg,化合价为+2价,Y的I2电离能突然增大,说明最外层有1个电子,应为Na,化合价为+1价,Z的I4电离能突然增大,说明最外层有3个电子,应为Al,化合价为+3价,同周期元素从左到右元素的电负性逐渐增强,则有电负性Na<Mg<Al,
故答案为:Mg、Na、Al;+2、+1、+3;Na<Mg<Al.
点评 本题考查元素电离能与电负性的递变,为高频考点,题目难度不大,本题注意根据电离能的变化判断元素核外电子排布为解答该题的关键,注意把握元素周期律的递变规律.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:多选题
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 镀锌制品镀层破损后,该铁制品比受损前更容易生锈 | |
| C. | 水中加入少量氯化铁固体,溶液中水的电离平衡:H2O?H++OH-正向移动 | |
| D. | 常温下pH=3的盐酸与pH=11的某碱溶液等体积混合溶液呈碱性,说明该碱为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4>NO2>O2 | B. | O2>SO3>H2SO4 | C. | NO2>O2>SO3 | D. | O2>NO2>SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
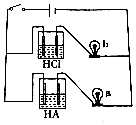
| A. | HA属于弱酸 | |
| B. | pH=1的HA溶液中由水电离出的c(H+)=10-13•L-1 | |
| C. | 等体积、等pH的HA和HCl溶液分别和NaOH溶液反应,HA消耗的NaOH较多 | |
| D. | 等体积的上述两种酸溶液分别和NaOH溶液反应,HA消耗的NaOH较少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室用如图所示的装置进行中和热测定实验.下列说法正确的是( )
实验室用如图所示的装置进行中和热测定实验.下列说法正确的是( )| A. | 用强酸和弱碱进行实验,测定的中和热(△H)一定为-57.3kg/mol | |
| B. | 实验过程中,将50mL 0.55mol/L的NaOH溶液逐滴加入到50mL 0.5mol/L的盐酸中 | |
| C. | 实验前用温度计先测量盐酸温度,再用该温度计直接测量NaOH溶液的温度 | |
| D. | 该实验需要计算生成水的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
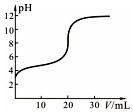 25℃时,用0.1000mol•L-1 KOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液,滴定中pH变化如图,下列关系错误的是( )
25℃时,用0.1000mol•L-1 KOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液,滴定中pH变化如图,下列关系错误的是( )| A. | V=0.00 mL时,CH3COOH溶液pH=3,其电离平衡常数K≈10-5mol•L-1 | |
| B. | V=10.00 mL时,溶液中c(CH3COO-)>c(K+)>c(H+)>c(OH-) | |
| C. | 溶液pH=7时,$\frac{c({K}^{+})•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$=1 | |
| D. | V≥20.00 mL时,溶液中c(K+)=c(CH3COO-)+c(OH-)+c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com