
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2012届江苏省南通市高三上学期期末调研测试化学试卷 题型:填空题
(12分)某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示: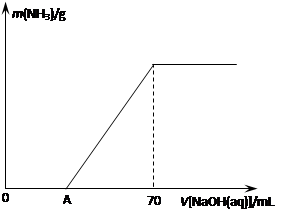
请回答下列问题:
⑴A点前样品与NaOH反应的离子方程式为 ▲ 。
⑵为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的 ▲ 。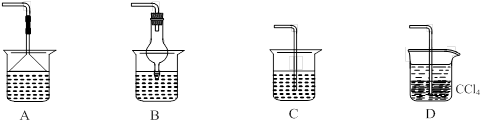
⑶样品中(NH4)2CO3的质量分数是 ▲ %(保留一位小数)。
⑷当V[NaOH(aq)]="50" mL时,生成NH3的质量为 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省扬州中学高三开学考试化学试卷(带解析) 题型:计算题
(15分)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。某校化学兴趣小组的同学为确定该方法所得固体的成分,称取该固体四份,溶于水后,分别逐滴加入相同浓度的硫酸溶液50 mL,产生SO2的体积(标准状况)如下表(实验时设法使水中溶解的SO2几乎完全逸出):
| 实验组别 | ① | ② | ③ | ④ |
| 硫酸溶液的体积(mL) | 50 | 50 | 50 | 50 |
| 盐的质量(g) | 9.260 | 13.890 | 20.835 | 32.410 |
| 二氧化硫的体积(mL) | 1344 | 2016 | 3024 | 2464 |
查看答案和解析>>
科目:高中化学 来源:2014届江西省景德镇市高三一检化学试卷(解析版) 题型:实验题
富马酸亚铁(分子式为C4H2O4Fe,结构简式为 )是一种限量使用的铁强化剂。
)是一种限量使用的铁强化剂。
(1)下图为实验室模拟工业制取富马酸亚铁的流程图:

①根据题意,请你写出富马酸的结构简式:________________________。
②绿矾(FeSO4·7H2O)在保存过程中形成的杂质主要有________(填化学式)。
③操作Y包括________、冷却结晶、过滤、洗涤、干燥等。
④判断操作Y中“洗涤”富马酸亚铁产品表明已洗净的实验方法是___________。
(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有KSCN溶液、H2O2溶液、稀硫酸。)。填写下表相应空格:
|
步骤 |
实验操作与现象 |
|
① |
取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
|
② |
|
|
③ |
|
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省扬州市高三第一学期检测试卷化学试卷(解析版) 题型:简答题
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:N2(g)+2H2(g)=N2H4(l) △H= + 50.6kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)采矿废液中的CN- 可用H2O2处理。已知:H2SO4=H++ HSO4-
HSO4-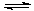 H++ SO42-
H++ SO42-
用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,S2O82-水解可以得到H2O2。写出阳极上的电极反应式 。
(3)氧化镁处理含 的废水会发生如下反应:
的废水会发生如下反应:
MgO+H2O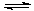 Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+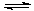 Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
①温度对氮处理率的影响如图所示。在25℃前,升高温度氮去除率增大的原因是 。

②剩余的氧化镁,不会对废水形成二次污染,理由是 。
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10 mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175 mL②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热③用25 mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol·L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL。则水样中氮的含量是 mg·L-1(用含c、V的表达式表示)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高三开学考试化学试卷(解析版) 题型:计算题
(15分)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。某校化学兴趣小组的同学为确定该方法所得固体的成分,称取该固体四份,溶于水后,分别逐滴加入相同浓度的硫酸溶液50 mL,产生SO2的体积(标准状况)如下表(实验时设法使水中溶解的SO2几乎完全逸出):
|
实验组别 |
① |
② |
③ |
④ |
|
硫酸溶液的体积(mL) |
50 |
50 |
50 |
50 |
|
盐的质量(g) |
9.260 |
13.890 |
20.835 |
32.410 |
|
二氧化硫的体积(mL) |
1344 |
2016 |
3024 |
2464 |
⑴上述四组实验中,SO2体积与固体的质量之比相同的组别有__________________;由第①组实验中的SO2体积与固体的质量之比,可以推算用6.945 g该固体进行同样的实验时,产生SO2_________mL(标准状况);根据表中 两组数据变化可确认该固体中一定含有(NH4)2SO3。
⑵另取9.260 g该固体与足量的熟石灰共热,收集到标准状况的氨气的体积为3136 mL,则该固体的成分除(NH4)2SO3外还有___________(填化学式),该实验中使用的硫酸的物质的量浓度为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com