
���� ��1��Ka��HNO2��=$\frac{c��{H}^{+}����c��N{{O}_{2}}^{-}��}{c��HN{O}_{2}��}$��$\frac{{c}^{2}��{H}^{+}��}{c��HN{O}_{2}��}$��
��2��������ʽ2��+3��-3�ܵ÷���ʽ�ڣ����ʱ������Ӧ�ĸı䣻
��3������ͼ֪��������NO�õ��Ӻ������ӷ�����ԭ��Ӧ����笠����ӣ���������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ�
��4���ٿ��淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ����Լ��ɴ������һϵ�����������䣻
���൱����С���������Ӧ��Ũ�ȣ�ѹǿ����ƽ�ⲻ�ƶ�������Ӧ��Ũ���൱������ѹǿ���÷�Ӧǰ�����������֮�Ͳ��䣬ѹǿ��Ӱ��ƽ���ƶ���
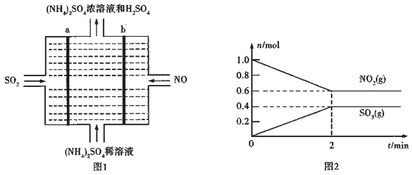
��������Ӧ�У���0��2min��SO2��ƽ����Ӧ����v��SO2��=v��NO2��=$\frac{\frac{��n}{V}}{��t}$��
�ܸ÷�ӦNO2��g��+SO2��g��?SO3��g��+NO��g����
��ʼ��mol/L��0.5 0.5 0 0
��Ӧ��mol/L��0.2 0.2 0.2 0.2
ƽ�⣨mol/L��0.3 0.3 0.2 0.2
��ѧƽ�ⳣ��K=$\frac{0.2��0.2}{0.3��0.3}$=$\frac{4}{9}$��
��� �⣺��1��Ka��HNO2��=$\frac{c��{H}^{+}����c��N{{O}_{2}}^{-}��}{c��HN{O}_{2}��}$��$\frac{{c}^{2}��{H}^{+}��}{c��HN{O}_{2}��}$=$\frac{1{0}^{-2}��1{0}^{-2}}{0.2-1{0}^{-2}}$=5.3��10-4��
�ʴ�Ϊ��5.3��10-4��
��2��������ʽ2��+3��-3�ܵ÷���ʽ�ڣ����H2=2��H1+3��H3-3��H4��
�ʴ�Ϊ��2��H1+3��H3-3��H4��
��3������ͼ֪��������NO�õ��Ӻ������ӷ�����ԭ��Ӧ����笠����ӣ���������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ�������ӦʽΪNO+5e-+6H+�TNH4++H2O���ʴ�Ϊ��NO+5e-+6H+�TNH4++H2O��
��4����A����Ӧǰ�������������䡢����������䣬���Ի�������ܶ�ʼ�ղ��䣬���ܸ��ݻ��������ܶ��ж�ƽ��״̬����A����
B����Ӧǰ���������������䡢���ʵ������䣬���Ի�������ƽ����Է�������ʼ�ղ��䣬���ܾݴ��ж�ƽ��״̬����B����
C�����������NO2����������ٸı�ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����C��ȷ��
D������������ɫ���ٸı�ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����D��ȷ��
��ѡCD��
���൱����С���������Ӧ��Ũ�ȣ�ѹǿ����ƽ�ⲻ�ƶ�������Ӧ��Ũ���൱������ѹǿ���÷�Ӧǰ�����������֮�Ͳ��䣬ѹǿ��Ӱ��ƽ���ƶ���������ת���ʲ��䣬
�ʴ�Ϊ���������䣻
��������Ӧ�У���0��2min��SO2��ƽ����Ӧ����v��SO2��=v��NO2��=$\frac{\frac{��n}{V}}{��t}$=$\frac{\frac{1-0.6}{2}}{2}$mol/��L��min��=0.15mol/��L��min����
�ʴ�Ϊ��0.15mol/��L��min����
�ܸ÷�Ӧ NO2��g��+SO2��g��?SO3��g��+NO��g����
��ʼ��mol/L��0.5 0.5 0 0
��Ӧ��mol/L��0.2 0.2 0.2 0.2
ƽ�⣨mol/L��0.3 0.3 0.2 0.2
��ѧƽ�ⳣ��K=$\frac{0.2��0.2}{0.3��0.3}$=$\frac{4}{9}$��
�ʴ�Ϊ��$\frac{4}{9}$��
���� ���⿼�黯ѧƽ���й����⣬Ϊ��Ƶ���㣬�漰��ѧƽ����㡢��Ӧ�����жϡ���˹���ɵ�֪ʶ�㣬��ȷ��ѧƽ��ԭ������˹���ɺ����ǽⱾ��ؼ���ע�⣨4���ⷴӦ�ص㵼��ѹǿ��Ӱ��ƽ���ƶ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ�鷽�� | Ԥ��ʵ������ | ��Ӧ���� | |
| A | ������Fe��NO3��3��Һͨ������H2S | �л�ɫ���� | Fe��NO3��3����Ԫ�ؾ��������� |
| B | CH3CH2Br��NaOH�Ҵ����Ⱥ�����ͨ�����Ը��������Һ | ���������Һ��ɫ | CH3CH2Br��NaOH�Ҵ���Һ����������ϩ |
| C | �ⶨ��ͬ�����µ����ʵ���Ũ�ȵ�CH3COONa��NaHCO3��pH | NaHCO3��Һ��pH�� | ���ԣ�̼����� |
| D | 10mL0.1mol/L��NaOH��Һ����2mL��Ũ�ȵ�MgCl2��Һ��Ȼ���ٵμ�FeCl3��Һ | �ȳ��ְ�ɫ�������������Ϊ���ɫ | Ksp[Fe��OH��3]��Ksp[Mg��OH��2] |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
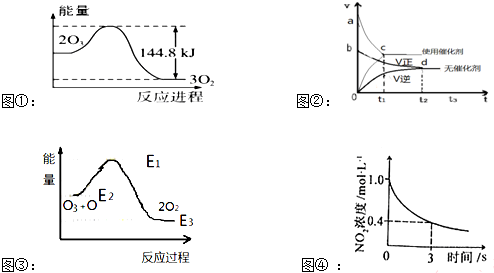
| A�� | ��ͼ�ٿ��жϣ�2O3��g��=3O2��g������H=-44.8KJ/mol | |
| B�� | ��ͼ�ڿ��жϣ�ij��Ӧ��ʹ�ô���ʱ������ʱ��Ӧ���ʴ������Saco��Sbdo | |
| C�� | ��ͼ�ۿ��жϣ�2O2��g���TO3��g��+O��g����H��0 | |
| D�� | ��ͼ�ܿ��жϣ�2NO2��g��+O3��g��?N2O5��g��+O2��g����0��3s�ڣ���Ӧ����ΪV��N2O5��=0.2mol•L-1•S-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ��� | H2C2O4��Һ | ����KMnO��Һ | �¶ȡ� | ||
| Ũ��/��mol•L-1�� | ���/mL | Ũ��/��mol•L-1�� | ���/mL | ||
| �� | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���շϾɵ�ص���Ҫԭ���ǻ���ʯī | |
| B�� | pH��5.6��7.0֮��Ľ�ˮͨ����Ϊ���� | |
| C�� | ����һ���Է��пɼ��ٰ�ɫ��Ⱦ | |
| D�� | ȼúʱ����������ʯ�ҿɼ��ٶ���������ŷ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
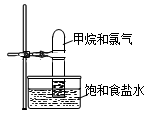 ����ͼװ�÷����ڹ����ĵط������۲쵽����ʵ�������Թ��ڱ�������״Һ�����ɡ�����ʳ��ˮ����������������������ɫ������ɫ��dz���Թ���Һ������������
����ͼװ�÷����ڹ����ĵط������۲쵽����ʵ�������Թ��ڱ�������״Һ�����ɡ�����ʳ��ˮ����������������������ɫ������ɫ��dz���Թ���Һ�������������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
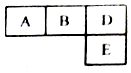 ��M��A��B��D��N��E���ֶ�����Ԫ��ԭ��������������MԪ�صĵ�������Ȼ����������壬NԪ�ص�ԭ�Ӱ뾶���������������ģ�A��B��D��E����Ԫ�������ڱ��е���Ӧλ������ͼ�����ǵ�ԭ������֮��Ϊ37������˵������ȷ���ǣ�������
��M��A��B��D��N��E���ֶ�����Ԫ��ԭ��������������MԪ�صĵ�������Ȼ����������壬NԪ�ص�ԭ�Ӱ뾶���������������ģ�A��B��D��E����Ԫ�������ڱ��е���Ӧλ������ͼ�����ǵ�ԭ������֮��Ϊ37������˵������ȷ���ǣ�������| A�� | �е㣺M2D��BM3��AM4 | |
| B�� | ԭ�Ӱ뾶��rE��rA��rB��rD | |
| C�� | ������AnM2n�����мȺ��м����I�ֺ��зǼ����I | |
| D�� | BԪ�ص��⻯����DԪ�صĵ�����һ���������ܷ����û���Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ4��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ӱ뾶��С˳��Ϊ��W��Z��R | |
| B�� | X2Z2�ĵ���ʽΪ��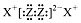 | |
| C�� | X2Z�ķе��X2W�ķе�� | |
| D�� | YԪ������������ˮ����Ũ��Һ��������������ʢװ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 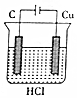 | B�� | 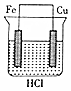 | C�� | 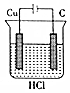 | D�� | 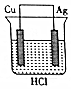 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com