
 示意图 ,
示意图 ,  阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | 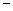 33.35 33.35 | 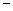 164 164 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ① | ② | ③ | ④ | |
| 3 | ⑤ | | ⑥ | ⑦ | | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | B | |
| A | X | C |
| | D | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 和
和 互为同位素,物理性质不同,化学性质几乎完全相同
互为同位素,物理性质不同,化学性质几乎完全相同查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com